www.mundonano.unam.mx | Mundo Nano
http://dx.doi.org/10.22201/ceiich.24485691e.2015.15.53868 | 8(15), 53-90, julio–diciembre 2015
Artículos de investigación
Nanopartículas catalíticas… ¿polvo mágico?1
María del Rocío Redón de la Fuente*
* Centro de Ciencias Aplicadas y Desarrollo Tecnológico, Universidad Nacional Autónoma de México, Cd. Universitaria, A.P. 70-186, C.P. 04510, Coyoacán, México D. F., México. Teléfono +52-55/5622-8602, ext. 1154. correspondencia: (rredon@unam.mx).
Resumen:
Con el inicio de la investigación en materiales con dimensiones nanométricas, pronto se descubrieron sus bondades enlazadas con su excepcional relación área superficial/ volumen, siendo uno de los ámbitos de mayor potencial de aplicación el de catalizadores. En particular, en las nanopartículas de metales del grupo del platino (rutenio, osmio, rodio, iridio, paladio, platino) se han invertido muchas horas de investigación para encontrar catalizadores con estas dimensiones que mejoren el desempeño cuando son empleados en una escala dimensional mayor. Entre la comunidad, algunos investigadores denominaban las nanopartículas de dichos metales involucradas en procesos catalíticos polvo mágico (magic dust), por las propiedades maravillosas que se les atribuyen, pero, ¿realmente se han encontrado grandes mejoras en cuanto al costo/beneficio de los materiales nanoestructurados? o, ¿cuáles han sido las aportaciones generadas con este tipo de investigaciones? En este trabajo se hace una descripción de los avances y descubrimientos en el área de catálisis homogénea (en una sola fase) con catalizadores nanoparticulados de estos metales, que se aplican principalmente en el área de la energía.
Palabras clave: nanopartículas metálicas, grupo del platino, catálisis heterogeneizada, polvo mágico.
Abstract:
Since the discovery of nanosized materials, one of the areas with the highest incidence was the study of catalysts. In particular researchers in catalysis have invested many hours of research to find catalysts in these dimensions to improve the properties of the present catalysts, using nanoparticles of platinum group metals (ruthenium, osmium, rhodium, iridium, palladium, platinum) for this purposes. Among the community, some researchers named magic dust to the nanoparticles of the metals involved in catalytic processes, because of the marvelous properties attributed to them. But, how really magic are them? Are there some improvements in the relationship, cost/benefit?, which have been the contributions to the catalysis field? This article will make a brief description of some advances and discoveries in the field of homogeneous catalysis (single phase) with nanoparticle catalysts of these metals.
Keywords: metallic nanoparticles, platinum group, heterogenized catalysis, magic dust.
Recibido: 27 de agosto de 2015.
Aceptado: 12 de octubre de 2015.
Introducción
Hace algunos años, alrededor de 2006, en mi camino hacia un congreso internacional de química inorgánica, me encontré con un grupo de investigadores, entre los que se encontraba Christofer W. Jones, quien al enterarse de que yo empezaba a trabajar con nanopartículas metálicas, exclamó con una sonrisa dibujada en su rostro: Ah! with magic dust , desde entonces, me quedé con la idea de que era una excelente descripción para los nanomateriales que estaba trabajando y decidí que algún día usaría el término para escribir un trabajo relacionado con ello. Y, es ahora la ocasión perfecta para emplearlo, cuando amablemente me han invitado a escribir este artículo, que aprovecho para dedicarlo a la descripción de estos polvos mágicos o magic dust como los denominó Jones.
Antecedentes
Para iniciar con este pequeño relato acerca de las nanopartículas metálicas como catalizadores, describiré primero qué es un catalizador, tomando para ello la descripción que hace van Leeuwen en su libro dedicado a la catálisis homogénea (van Leeuwen, 2004). De acuerdo con la definición original que dio Ostwald en 1895, “un catalizador es una sustancia que cambia la velocidad de una reacción química sin que el compuesto que funciona como catalizador aparezca en los productos”, de acuerdo con esta definición, un catalizador puede acelerar o disminuir la velocidad de una reacción química. En la actualidad: “un catalizador es una sustancia que incrementa la velocidad a la cual una reacción química se aproxima al equilibrio sin que el compuesto que funciona como catalizador permanezca permanentemente involucrado”. Así pues, el catalizador puede incorporarse a la reacción mediante un precursor catalítico que requiere activarse. Durante el ciclo catalítico, este catalizador puede estar presente en diferentes formas intermedias sin que se altere su configuración química. El número de veces que el catalizador interviene en este ciclo catalítico es lo que se conoce como número de recambio (TON, por sus siglas en inglés), así pues el TON es el número total de veces que el catalizador convierte en moléculas del producto las moléculas de sustrato. Por otro lado, la frecuencia de recambio (TOF, por sus siglas en inglés) es el número de recambio en un cierto periodo de tiempo.
Dentro del mundo de la catálisis, es importante saber que los sustratos de la reacción se encuentran en proporciones mucho mayores que los catalizadores, por lo que la relación sustrato:catalizador juega un papel importante. También existen inhibidores, que son sustancias que retardan una reacción, normalmente los inhibidores se encuentran en cantidades denominadas “catalíticas” o subestequiométricas. Estos inhibidores pueden ser sustancias que se adsorben en el metal, haciéndolo menos activo o bloquear los sitios de coordinación del metal para enlazar los sustratos. También existen los venenos, siendo éstos sustancias que detienen la reacción catalítica. Un veneno puede matar al catalizador, se dice que muere porque pierde su actividad catalítica, y se tiene que regenerar para que vuelva a funcionar como catalizador. Otro término empleado para describir las reacciones catalíticas es el cocatalizador, sustancia que forma parte del catalizador mismo o juega otro rol en alguna parte del ciclo catalítico.
Existen diferentes tipos de reacciones catalíticas; está la catálisis homogénea, en la que tanto el catalizador como los reactivos se encuentran dispersados en la misma fase, que puede ser líquida o gaseosa. Por otro lado, se encuentra la catálisis heterogénea (Figura 1), en la que el catalizador y los reactivos se encuentran en diferentes fases, normalmente los catalizadores heterogéneos son sólidos y los reactivos son líquidos o gases (Jolly, 1989).
Figura 1 Esquema de catalizador tipo heterogéneo.
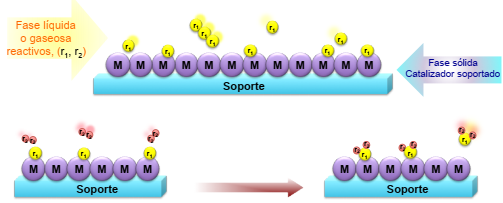
Fuente: Elaboración propia.
En el caso de los catalizadores que contienen metales de transición, éstos proveen un sitio, donde el paso determinante de la velocidad de la reacción puede llevarse a cabo de forma más sencilla que en la ausencia del catalizador. La energía de activación de la reacción catalizada es menor que aquella que no incluye un catalizador y, por lo tanto, la reacción catalizada es más rápida que la no catalizada. Generalmente, una reacción catalizada es la suma de una secuencia de pasos de reacción y, sólo uno de estos pasos es determinante de la velocidad de la reacción (Jolly, 1989). Entonces, un catalizador disminuye la barrera de activación de la reacción, es decir, disminuye la energía de activación (Figura 2).
Figura 2 Esquema de energía, que muestra las diferentes energías de activación relativas. En una reacción sin catalizador; con un catalizador molecular y con un nanocatalizador.
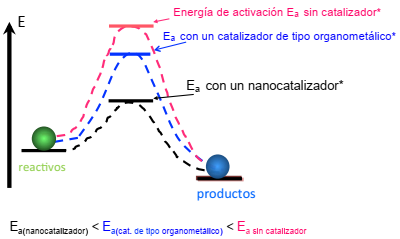
Fuente: Elaboración propia.
Uno de los actores involucrados en los catalizadores son los metales nobles, denominados así porque son metales que en estado natural y en condiciones ambientales no reaccionan con el oxígeno del medio ambiente, eso les permite permanecer sin reaccionar hasta que se les necesite, en las reacciones catalíticas.
A este grupo de metales, pertenecientes a los metales de transición, se les denomina nobles o del grupo del platino (Jolly, 1989), e incluyen al rutenio, rodio, paladio, osmio, iridio y platino (Figura 3). Estos metales son los que usualmente conforman los compuestos catalizadores, generalmente compuestos de tipo organometálico.
Figura 3 Tabla periódica donde se muestra el grupo de metales del grupo del platino (rutenio, rodio, paladio, osmio, iridio y platino) y metales que se emplean comúnmente como catalizadores (se incluyen además de los metales del grupo del platino a la plata y el oro).
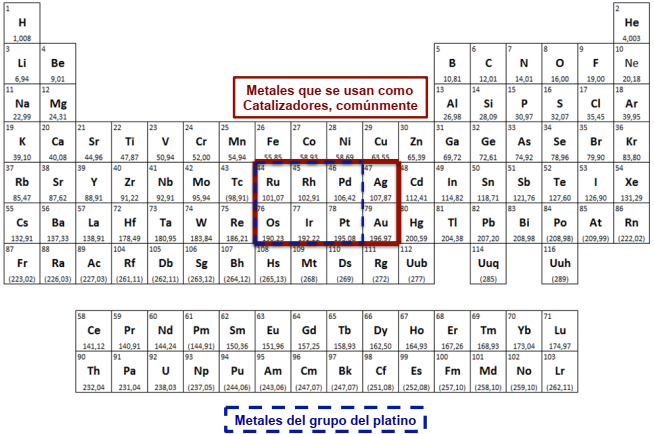
Fuente: Jolly (1984).
Uno de los inconvenientes al usar compuestos organometálicos con metales nobles es su elevado costo debido a su escasez en la naturaleza, y, consecuentemente, los procesos industriales en los que se emplean también lo son; además, a pesar de que los catalizadores se recuperan al final de la reacción para ser reutilizados, algo de éstos se va perdiendo en cada recuperación y lavado.
Además de los catalizadores involucrados en las reacciones de tipo homogéno y de tipo heterogéneo, existen otros que se encuentran en dispersión coloidal y es por esta condición que están inmersos en una disolución, pero son tan pequeños que pareciera que pertenecen a la fase homogénea, aunque no sea así, algunos los han descrito como catalizadores heterogeneizados (Redón, 2014).
Dichos catalizadores heterogeneizados presentan fenómenos de superficie; estrictamente hablando, no están en la misma fase, pero pueden generar compuestos que se disuelvan, se involucren en un ciclo de catálisis homogénea y generen nuevamente los catalizadores heterogeneizados (Phan, 2006), (Figura 4). Pueden funcionar como reservorios de los catalizadores (Figura 4) propiamente dichos, por lo cual también se les denomina pre-catalizadores; de manera que se pueden tener las propiedades de los catalizadores heterogéneos, que se suman a las propiedades del catalizador homogéneo, con un efecto sinérgico y favorecen el efecto catalítico (Araque, 2013).
Figura 4 Esquema de reacciones catalíticas que involucran catalizadores heterogeneizados.
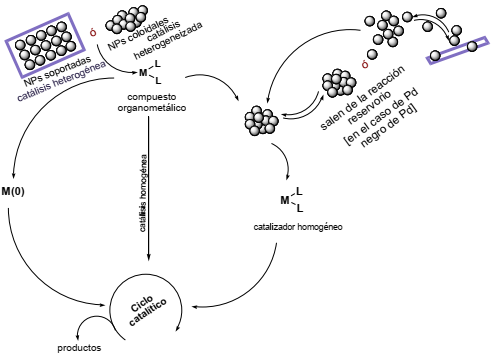
Fuente: Elaboración propia.
Justamente, estos catalizadores heterogeneizados de los que estamos hablando son las nanopartículas metálicas, que, además de todas las características que he mencionado, también presentan todas las propiedades que les confiere su tamaño, tal como la relación área superficial/volumen.
Para explicar esta característica que hace que los catalizadores en estas dimensiones sean tan interesantes y se consideren para sustituir a los catalizadores de tipo organometálico, utilizaremos un cubo (Figura 5); si este cubo tiene aristas de 1 m de longitud y calculamos su superficie, nos dará un valor de 6 m2, si ahora dividimos es mismo cubo, en cubos de 0.1m de arista, tendremos 1000 cubos, si calculamos nuevamente su área superficial y sumamos las áreas de todos los cubitos obtenidos, obtenemos un área de 60 m2, si seguimos dividiendo el cubo hasta obtener cubos con una longitud de arista del tamaño de 1 nm, entonces tendremos 1027 cubos que generarán un área superficial de 6 × 109 m2 (6000 km2) de área superficial y con el mismo volumen (Cornejo, 2015).
Figura 5 Representación de la relación área/volumen en compuestos de dimensiones nanométricas.
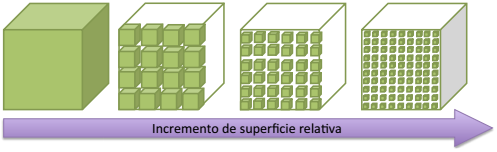
Fuente: Elaboración propia
Es así como el área superficial de los nanocatalizadores es mucho mayor que la que se tiene para los compuestos de tipo organometálico, lo cual representa una mayor oportunidad de que se lleven a cabo las reacciones con menores cantidades de catalizador y con los mismos o mejores resultados. Por lo tanto, se puede usar una menor cantidad de metal, disminuyendo el costo de producción.
Ahora bien, el manejo de estos nanocatalizadores con sus enormes áreas superficiales se encuentra más activo que el de los catalizadores tipo organo-metálico. Requiriendo moléculas protectoras para que no reaccionen con el oxígeno ambiental, con lo cual el costo de obtención se incrementa, pues muchas veces estas moléculas protectoras son de síntesis largas y complejas.
Las reacciones en las que se encuentran involucrados los metales nobles cuando funcionan como catalizadores son muchas (van Leewen, 2004) y muy variadas (Tabla 1), y quise incluirlas en este artículo porque no siempre se es consciente de todas las reacciones químicas involucradas cuando se trata de catálisis; con esta larga lista, es más claro poder entender que la gran mayoría de los procesos químicos son procesos catalíticos, y ser conscientes de que más del 80% de los productos de la industria química involucran un catalizador en una u otra fase de su producción.
Tabla 1 Reacciones catalíticas en las que participan metales nobles como catalizadores.
Hidroformilación Acoplamiento cruzado tipo Heck Ciclopropanación Síntesis y descomposición de amoníaco Reducción de enlaces insaturados Borilación de alquenos Oxidación de NaBH4 Rearreglo 2,3-sigmatrópico Reducción de compuestos nitro Adición de aromáticos a alquenos (reacción de Murai) Hidrosililación Metátesis de olefinas (catalizador de Grubbs) Inserción de C-H Epoxidación Oxidación de compuestos orgánicos Fischer-Tropsch Hidrogenación selectiva de carbonilos α β insaturados Hidroxilación de enlaces insaturados Reducción de CO Inserción de N-H Polimerización de apertura de anillo
Hidrosililación Apertura de anillo Hidrogenación de derivados bencénicos Deshidrogenación Hidrogenación de arenos Borilación de alquenos Ciclometanación Hidrogenación asimétrica Borilación de benceno Hidrogenación de acetona Carbonilación de metano y acetato de metilo (proceso Monsanto)
Hidrosililación de alquenos Oxidación de alquenos (proceso Wacker) Acoplamiento cruzado C-C Ciclopropanación Carbonilación de alquenos Reducción de alquenos y alquinos Oxidación de NaBH4 Copolimerización de CO/eteno Isomerización Reducción de compuestos nitro Carbonilación de metanol y acetato de metilo Polimerización de alquenos Inserción de alquenos Metoxi-carbonilación de estireno Reducción de CO Hidroxilación de enlaces insaturados Hidrogenación Oxidación de compuestos orgánicos Metátesis de olefinas Inserción de C-H Epoxidación Fischer-Tropsch Inserción de N-H
Carbonilación de Metano y acetato de metilo (proceso Monsanto) Oxidación de compuestos orgánicos Hidrosililación Apertura de anillo Hidrogenación de α-cetoésteres Reducción de enlaces insaturados Hidroformilación Deshidratación Deshalogenación Hidrogenación (catalizador de Wilkinson) Formilación de sililos Ciclopropanación enantioselectiva Oxidación parcial de alcoholes Oxidación parcial de olefinas Borilación de alquenos Hidrogenación selectiva de carbonilos α β insaturados Isomerización Oxidación de CO
Craqueo del petróleo Síntesis de H2SO4 Reducción de oxígeno Oxidación de CO Reducción de fenoles Oxidación de metanol Hidrogenación de etileno y pirrol Hidrodeclorinación de monoclorobenceno Oxidación electroquímica de ácido fórmico Carbonilación de metanol y acetato de metilo (proceso Monsanto) Inserción de alquenos Hidroformilación Isomerización Hidrogenación de propeno Hidrogenación de fenil aldehídos Conversión de ácido cinámico Hidrogenación de derivados del nitrobenceno Conversión de alcohol isopropílico Hidrogenación enatioselectiva Hidrosililación Catálisis electrofílica
Reducción de compuestos nitrogenados Degradación fenólica Epoxidación Oxidación del etanol Oxidación de moléculas
Oxidación de óxido nítrico Deshidrogenación de etanol Oxidación de glucosa Reducción de nitrofenol Isomerización de epóxidos Oxidación de feniletanol Oxidación de metanol Electro oxidación de CO Fuente: Elaboración propia.
RUTENIO
IRIDIO
PALADIO
RODIO
PLATINO
PLATA
ORO
Con este antecedente, el estudio de los nanocatalizadores se hace indispensable y fundamental, considerando que pueden ser más económicos, más verdes y con la esperanza de que se tenga mayor productividad, con respecto a los catalizadores de tipo organometálico, por su extraordinaria reactividad y capacidad de almacenamiento de electrones en exceso (Pastoriza-Santos, 2006).
Como se mencionó anteriormente, los nanocatalizadores requieren de moléculas protectoras para ser transportados; en la Tabla 2, se ha enlistado una serie de sistemas nanoestructurados que contienen nanopartículas de metales del grupo del platino y las reacciones catalíticas en las que se ha probado su efectividad; nuevamente, se puede observar que las reacciones en las que son eficientes son prácticamente las mismas que presentan los compuestos de tipo organometálico. El caso del oro es un poco diferente, pues no fue sino hasta que se trabajó en tamaños nanométricos que se pudo emplear como catalizador (Haruta, 1987).
Tabla 2 Ejemplos de reacciones catalizadas por nanopartículas de metales nobles.
Fuente: Elaboración propia.
METAL: RUTENIO (Ru)
PARTÍCULA
REACCIONES CATALÍTICAS
REFERENCIA
NPs de Ru0/γ-Al2O3
Hidrogenación de benzoato de metilo
Marconi et al., 2004
NPs de Ru0/γ-Al2O3 PVP
Hidrogenación fenólica
Raspolli et al., 2009, Raspolli et al., 2008
NPs de Ru0/membranas de alúmina nanoporosa
Hidrogenación de 1,3-butadieno
Pelzer et al., 2003
Ru/sílica, sílica modificada con PVP
Hidrogenación de aromáticos
Zhou et al., 2009
[Ru-(C6Me6)2Mo5O18Ru(C6Me6)(H2O)]/ sílica mesoporosa del tipo SBA-15
Hidrogenación de benceno
Boudjday et al., 2007
NPs de Ru0/sílica, sílica recubierta con carbon, y NPs de Ru0 templadas con carbon mesoporoso
Hidrogenación de benceno y tolueno
Lu et al., 2007
Reducción de citral
Meric et al., 2006
Ru0/montmorilonita y bromuro de cetiltrimetil amonio
Hidrogenación de citral
Manikandan et al., 2008
Ru0/trifluoroacetato de1,1,3,3-tetrametilguanidinio
Hidrogenación de benceno
Miao et al., 2006
Ru0/NPs de hidróxido de colina/óxido
Hidrogenación de
Lakshmi et al., 2008
de magnesio
compuestos carbonílicos
NPs de Ru0/nanofribras de carbón
Hidrogenación de paracetamol
Asedegbega et al., 2008
NPs de Ru0/nanofribras de carbón
BINOL hidrogenación parcial de tolueno y benceno
Takasaki et al., 2007; Takasaki et al., 2007; Su et al., 2007
Ru0/NPs de ciclodextrinas metiladas/ carbón
Hidrogenación de xileno
Denicourt et al., 2008
Ru0/ciclodextrinas metiladas y/o NPs de N,N-dimetil,N-hexadecil,N-(2- hidroxietilo) de amonio /carbón
Hidrogenación de derivados areno, alqueno, arilo
Hubert et al., 2009; Denicourt et al., 2007;
Nowicki et al., 2006
NPs de Ru0/zeolita
Isomerización
Sun et al., 2003
Ru0/furanosa derivada de ligante difosfito
Hidrogenación enantioselectiva
Gual et al., 2008
NPs de Ru0/líquidos iónicos
Hidrogenación de arenos
Prechtl et al., 2008; Rossi et al., 2008
NPs de Ru0/PVP
Hidrogenación de arenos y proceso Fischer Tropsch
Lu et al., 2007; Xiao et al., 2008
NPs de Ru0/SiO2, TiO2, ZrO2, MgO, NaY zeolita, HY zeolita, H-β-zeolita, grafito y nantotubos modificados de carbono
Proceso Fischer-Tropsch
Kang et al., 2009
NPs de Ru0/OAPS
Reducción de fenilaldehídos
Li et al., 2007
NPs de Ru0/poliorganofosfacenos
Hidrogenación de varios grupos insaturados
Spitaleri et al., 2003
NPs de Ru0/fluoruro de magnesio
Reducción de o-cloronitrobenceno
Pietrowski et al., 2009
NPs de Ru0-PVP/SnO2
Hidrogenación de o- cloronitrobenceno
Zuo et al., 2004
NPs de Ru0/γ-Al2O3
Descomposición de amoníaco
Zheng et al., 2007
NPs de Ru0/ZrO2-KOH, nanotubos de carbón, MgO, carbón activado y Al2O3
Descomposición de amoníaco
Yin et al., 2006; Yin et al., 2004
NPs de Ru0/SBA-15, TiO2 y γ-Al2O3
Oxidación parcial de metano
Li et al., 2004; Perkas et al., 2005; Balint et al., 2003; Balint et al., 2003, y 2002
NPs de Ru0/ZrO2-SiO2, ZrO2- grafito- dodecilsulfato de sodio y carbón activado
Oxidación de arenos y ácidos carboxílicos
Castillejos et al., 2009; Perkas et al., 2005
NPs de Ru0/matriz de poliestireno hipercruzado (HPS)
Oxidación de D-glucosa a D-ácido glucónico
Marveeva et al., 2009
NPs de Ru0/ hidrotalcita de Mg-Al
Síntesis de amoníaco
Seetharamulu et al., 2009
Ru0 NPs/Cs-MgO
Síntesis de amoníaco
Larichev et al., 2007
NPs de Ru0-2-ácido metacrílico3-(bis-carboximetilamino)-2- hidroxipropil éster (GMA-IDA)/ microesferas de poliestireno
Descomposición de NaBH4
Chen et al., 2009
Ru0/LiCoO2
Descomposición de NaBH4
Liu et al., 2008
Ru0/acetato de sodio
Descomposición de NaBH4
Özkar et al., 2005
NPs de Ru0/derivados de poliestireno
Reacciones de transferencia inter- e intra-carbenoides, inserción catalítica inter- e intramolecular N-H carbenoides Ciclopropanation, tándem intramolecular de ilida de amonio/rearreglo intermolecular [2,3]-sigmatrópicos, ciclopropanation de alquenos
Choi et al., 2008
NPs de Ru0-H5PV2Mo10O40 (POM)/ α-Al2O3
Epoxidación de alquenos
Maayan et al., 2005
NPs de Ru0/hidroxiapatita
Hidroxilación cis y anclaje oxidativo de alquenos
Ho et al., 2004
Ru/Al2O3-tetraoctilamina (TOA) o dodecilamina
Acoplamientos tipo Heck y Suzuki
Na et al., 2004
METAL: RODIO (Rh)
Rh0/ aluminosilicatos mesoporosos modificados con cloruro amónico de N,N-dimetil-N-cetil-N-(2-hidroxietilo)
Hidrogenación de derivados de areno
Boutros et al., 2008
NPs de Rh/MCM-41
Hidrogenación de arilo
Boutros et al., 2006, Mévellec et al., 2006
Rh0/sílica modificada con cloruro amónico de N,N-dimetil-N-cetil-N-(2-hidroxietilo)
Hidrogenación de arilo
Barthe et al., 2009
NPs de Rh0/sílica amino modificada-recubierta con Fe3O4
Hidrogenación de ciclohexeno y benceno
Jacinto et al., 2008
NPs de Rh0-PVP/ nanostructura core-shell de carbono
Hidrogenación de arilo
Harada et al., 2008
NPs de Rh0/carbón vegetal
Hidrogenación de areno
Park et al., 2007
NPs de Rh0(MWCNT)
Hidrogenación de areno
Yoon et al., 2009; Yoon et al., 2005; Kakade et al., 2008
NPs de Rh0/H2O-CO2
Hidrogenación enantioselectiva de areno
Ohde et al., 2002
Rh/Al2O3
Hidrogenación de areno y sililformilación
Hoxha et al., 2009; Evangelisti et al., 2008; Vitulli et al., 2003
[Rh/AlO(OH)]
Hidrogenación de areno areno
Soo et al., 2007; Gelesky et al., 2007
NPS de Rh0- tetrafluoroborato de1-N-butil-3 metilimidazolio IL /SiO2
Hidrogenación de areno y alqueno
Gelesky et al., 2007
NPs de Rh0/ sales de tetraalkilamonio
Hidrogenación de areno ciclohexeno y benceno Hidrogenación de enlaces insaturados
Cimpeanu et al., 2009
NPs de Rh0 stabilizadas con líquidos iónicos
Redel et al., 2009; Fonseca et al., 2005 y 2003
NPs de Rh0-PVP stabilizadas con líquidos iónicos
Hidrogenación de alqueno
Yang et al., 2008
NPs de Rh0/ copolímero; poli[(N-Vinil-2-pirrolidona)-co-(cloruro de 1-vinil-3- alkilimidazolio)]
Hidrogenación de arilo
Zhao et al., 2007; Mu et al., 2005
NPs de Rh0/ligantes bipiridina
Hidrogenación de areno y alqueno
Léger et al., 2008; Léger et al., 2008
NPs de Rh0/PVP
Hidrogenación de arilo y alqueno
Borsla et al., 2001; Pellegatta et al., 2002
NPs de Rh0/ sales de N,N-dimetil-N- cetil-N-(2-hydroxietil)amonio
Hidrogenación de arilo
Léger et al., 2007; Mévellec et al., 2004; Roucoux et al., 2003; Schulz et al., 2002
NPs de Rh0/alúmina
Apertura de anillo
Rodríguez et al., 2007
NPs de Rh0/CeO2
Apertura de anillo e hidrogenación de CO
Fuchs et al., 2005; Jenewein et al., 2003
NPs de Rh0/SiO2
Apertura de anillo e hidrogenación de CO
Fuchs et al., 2005
NPs de Rh0/FSM-16 material silíceo
hidrogenólisis de butano
Fukuoka et al., 2001
Rh0 ligante; (R)-2,2-bis-(difenilfosfino)- 1,1-binaftil ((R)-BINAP) y bromuro de tetraoctilamonio (TOAB)/SiO2
Hidroformilación regioselectiva
Han et al., 2008
NPs de Rh0- ligantes difosfito quirales
Hidroformilación regioselectiva
Axet et al., 2008
NPs de Rh0-amidas spoli(etilen imina) (PEI)
Hidroformilación
Tuchbreiter et al., 2007
NPs de Rh0/9,9-dimetil-4,5- bis(difenilfosfino)xanteno (Xantfos)
Hidroformilación regioselectiva
Bruss et al., 2006
NPs de Rh0/geles poliónicos
hidrosililación regio- y estereoselectiva
Thiot et al., 2006
NPs de Rh0/γ-Al2O3
hidrosililación estereoselectiva
Vitulli et al., 2003; Caporusso et al., 1999
NPs de Rh0- citrato de sodio -PVP/ SBA-15
Oxidación de CO
Grass et al., 2009
NPs de Rh0/γ-Al2O3
Oxidación de CO
Newton et al., 2006
NPs de Rh0/ polipirrol
Oxidación de alcoholes
Hasik et al., 2009
NPs de Rh0/TiO2
Oxidación de propileno
Duan et al., 2007
Rh/CexZr1-xO2-Al2O3
Reformado de etanol con vapor
Montini et al., 2007
Rh/Ce0.2Zr0.8O2-Al2O3
Reacción de desplazamiento de gas agua
Rogatis et al., 2008
METAL: PALADIO (Pd)
NPs de Pd
Acoplamiento cruzado tipo Heck
Astruc et al., 2007; Astruc et al., 2005
NPs de Pd
Acoplamiento curzado tipo Heck
Trzeciak et al., 2007
NPs de Pd
Acoplamiento cruzado tipo: Mizoroki-Heck y Suzuki- Miyaura
Phan et al., 2006
Pdn+ y NPs de Pd
Acoplamientos cruzados
Farina et al., 2004
NPs de Pd
Acoplamiento cruzado C-C
Favier et al., 2009
NPs de Pd
Reacciones de hidrogenación
Durand et al., 2008
NPs de Pd/dendrímero
Andrés et al., 2007
NPs de Pd/dendrímero
Acoplamiento curzado tipo Heck
Redón et al., 2009
NPs de Pd/negro de carbón, carbón activado, y/o carbón mesoporoso
Oxidación de benzaldehído e hidrogenación de cinamaldehído
Harada et al., 2007
NPs de Pd encapsuladas en graffito
Hidrogenación de 1-buteno, cis-2-penteno y ciclohexeno; e isomerización de 1-buteno y cis-2-penteno
Mastalir et al., 2001
NPs de Pd/MWCNT
Hidrogenación selectiva de cinamaldehído
Tessonnier et al., 2005
NPs de Pd/ MWCNTs modificados con líquidos iónicos
Hidrogenación de olefinas
Chun et al., 2008
NPs de Pd/arcilla sepiolita modificada con líquidos iónicos
Hidrogenación de olefinas y acoplamientos cruzados de C-C
Tao et al., 2009
NPs de Pd/líquido iónico-nanofibras de carbono (CNF) ancladas a fibras metálicas sinterizadas (SMF)
Hidrogenación parcial de acetileno
Ruta et al., 2008
NPs de Pd/líquidos iónicos
Hidrogenación de olefinas
Hu et al., 2008
NPs de Pd/líquidos iónicos
Hidrogenación parcial de1,3-butadieno
Umpierre et al., 2005
NPs de Pd/dendrímero
Hidrogenación de alcoholes alílicos
Zhao et al., 1998; Niu et al., 2001; Oh et al., 2005
NPs de Pd/dendrímeros ferrocenilo“click” y dendrímeros trazolilo
Hidrogenación de estireno y alcoholes alílicos
Ornelas et al., 2007; Ornelas et al., 2008
Pd NPs/Al2O3
Hidrogenación de 1-hexeno y trans-3- hexeno
Okitsu et al., 2000
NPs de Pd/poli(ácido acrílico) (PAA) y películas delgadas de polietilenimina (PEI)-α-Al2O3
Hidrogenación de1-propen-3-ol
Bhattacharjeee et al., 2008 y 2009
NPs de Pd embebidas en PAA y/o películas delgadas PEI/alúmina
Hidrogenación de alcoholes alílicos
Kidambi et al., 2005 y 2004
NPs de Pd/tapete de nanofibras de poli(amidoimida)
Hidrogenación de metil-cis-9-octadecenoato
Ebert et al., 2008
NPs de Pd/poli(acrionitrilo-co-ácido acrílico
Hidrogenación de3,7-dimetiloct-6-ene-1-ine-3-ol
Demir et al., 2004
NPs de Pd/SiO2
Hidrogenación parcial de1-heptine
Somboonthanakij et al., 2007
NPs de Pd stabilizadas con n-dodecil sulfuro/sílica
Hidrogenación de olefinas
Ganesan et al., 2007
NPs de Pd/ligantes dendríticos base poli(imin éter) fosfino-sílica modificada
Hidrogenación de olefinas
Jayamurugan et al., 2009
NPs de Pd /MCM-41
Hidrogenación de alquinos
Mastalir et al., 2007
NPs de Pd
Hidrogenación parcial de1-hexine
Semagina et al., 2007
NPs de Pd estabilizadas con bromuro de cetiltrimetilamonio (CTAB)
Hidrogenación de 2-metil-3-butin-2-ol
Semagina et al., 2009
NPs de Pd/ bromuro de cetiltrimetilamonio (CTAB)
Hidrogenación de 2-metil-3- butin-2-ol
Semagina et al., 2007
NPs de Pd/metacrilato de glicidilo (GMA), estireno y micelas estabilizadas con copolímero de etilen glicol- dimetacrilato/alúmina
Hidrogenación de 2-butin-1,4-diol, 2-buten-1,4-diol, y fenilacetileno
Semagina et al., 2005; Drelinkiewicz et al., 2008
Pd encapsulado en: poliisopreno hidroxilado (PHI), poli(2-cinamoiloxietil metacrilatado) reticulado (PCEMA), y NPs de poli(ácido acrílico) (PAA)
Hidrogenación de bromuro de trietilalil amonio (TEAA), ácido vinilacético (VAA), metil metacrilato (MMA) y etilen glicol dimetacrilate (EGDMA)
Underhill et al., 2000
NPs de Pd/bromuro de cetiltrimetilamonio (CTAB)
Hidrogenación de1,3-butadieno
Piccolo et al., 2008
NPs de Pd/bromuro de cetiltrimetilamonio (CTAB)
Hidrogenación de olefinas
Yoon et al., 2003
NPs de Pd/H2SO4-HNO3 MWCNTs modificados en CO2 supercrítico
Hidrogenación de trans- stilbeno
Ye et al., 2004
NPs de Pd/polietileno de alta densidad (HDPE) fluoropolymer (PFA) granulado y tubular
Hidrogenación de benceno y de fenol
Ohde et al., 2004
NPs de Pd microemulsiones de agua-en-CO2
Hidrogenación de olefinas
Ohde et al., 2002
NPs de Pd soportadas en sílica mesoporosa SBA-15 en condiciones supercríticas
Hidrogenación de 4-ácido metoxicinámico bencil éster
Lee et al., 2006
NPs de Pd/CO2 supercrítico
Hidrogenación de citral
Meric et al., 2004
NPs de Pd/CO2 supercrítico
Hidrogenación de citral
Meric et al., 2004
Pd/zeolita H-Y
Hidrogenación de olefinas
Mandal et al., 2004
Pd/embebidas dentro de una red de quitosano
Redución de 4-nitrofenol
Murugadoss et al., 2008
METAL: PLATA (Ag)
Ag/soportadas en PVP
Redución de 4-nitrofenol
Liu et al., 2009
Ag/soportadas en β-quitina
Redución de 4-nitrofenol
Jia et al., 2008
NPs coloidales de Ag
Redución de 4-nitrofenol
Pradhan et al., 2002
NPs de Ag soportadas sobre TiO2
Fotodegradación de cromóforo comercial reactivo amarillo-17 (RY-17)
Valentine et al., 2007
NPs de Ag soportadas sobre microfibras
Redución de azul de metileno
Demir et al., 2008
NPs de Ag soportadas sobre microfibras
Redución de amoníaco
Kundu et al., 2003
NPs de Ag soportadas sobre TiO2
Degradación de fenol
Li et al., 2009
NPs de Ag estabilizadas con PVP
Oxidación de estireno
Xu et al., 2006
NPs de Ag estabilizadas con surfactantes y soportadas sobre TiO2 o V2O5/TiO2
Oxidación de CO2 y H2O
Debecker et al., 2008
NPs de Ag soportadas sobre SBA-15
Oxidación de CO
Tian et al., 2009
NPs de Ag soportadas sobre hidroxiapatita (Hap)
Oxidación de fenilsilanos
Mitsudome et al., 2008
La2O3
Redución de NOx
Fokema et al., 1998
METAL: OSMIO (Os)
Nanoisla de Os sobre Pt(111)
Oxidación de etanol
Pacheco et al., 2007
METAL: IRIDIO (Ir)
Ir/líquido iónico
Hidrogenación de alquenos, dienos, arenos y quetonas
Migowski et al., 2007
Ir/tamiz molecular
Hidrogenación de acetona
Özkar et al., 2005
Ir/surfactante
Hidrogenación de arenos
Mévellec et al., 2004
Ir/ líquido iónico
Borilación de benceno
Yinghuai et al., 2008
Ir/diferentes “ligantes encapsuladores”
Hidrogenación de 1-deceno
Stowell et al., 2005
Ir-Al2O3
Apertura de anillo del ciclohexano
Rodríguez et al., 2007
Ir-Al2O3
Hidrogenación de benceno y tolueno
Cunha et al., 2002
Ir-SiO2/alcaloides cincona
Hidrogenación de acetofenona
Yang et al., 2009
Ir-SiO2/TOAB
Hidrogenación de 1-deceno
Gupta et al., 2006
Ir/AlO(OH)
Hidrogenación de areno y cetona
Park et al., 2007
METAL: PLATINO (Pt)
Pt/poliaril éter dendrímero de amin diacético ácido
Hidrogenación de derivados de nitrobenceno
Yang et al., 2006
Hidrogenación de fenil aldehídos
Du et al., 2006
Pt-SiO2/PAMAM como plantilla, diferentes tamaños
Hidrogenación de etileno y pirrol
Huang et al., 2008
Hidrogenación de tolueno, oxidación de CO
Lang et al., 2003
Pt/PPI and PAMAM
Reducción de 4-nitrofenol
Esumi et al., 2004
Pt/PAMAM
Reducción electrocatalítico de oxígeno
Crooks et al., 2007
Pt/poliestireno hipercruzado y cinconidina como modificador quiral
Hidrogenación enantioselectiva de etilpiruvato
Bykov et al., 2009
Pt/hiperramificado poli(amidoamina)
Hidrogenación de isoforona
Marty et al., 2008
Pt/MWCNT/PBI
Oxidación de metanol
Okamoto et al., 2009
Pt/MWCNT/PANI
Oxidación electroquímica de ácido fórmico
Zhu et al., 2008
Pt/fibras de negro de carbono o SWCNT
Celdas de combustible PEM
Taylor et al., 2008
Pt/PPy o PANI
Conversión de alcohol isopropílico
Hasik et al., 2009
Pt/Al2O3 y ácido poliacrílico como agente encapsulador
Hidrogenación de propeno
Yoo et al., 2002
Pt/cetonas y/o polímeros como plantilla, cinconidina o cinconina como modificador quiral
Hidrogenación enantioselectiva de etil piruvato
Collier et al., 1999
Pt/PVP
Deshalogenación e hidrodearomatización de monoclorobenceno
Liu et al., 2009
Pt-MCM-41/PVP como plantilla
Hidrogenación de ácido cinámico
Lin et al., 2004
Pt/nanoalambres de PPy
Oxidación electroquímica de metanol y reducción de oxígeno
Li et al., 2007
Pt/silsesquioxanos de octa(aminofenilo diacético)
Hidrogenación de fenil aldehídos
Li et al., 2007
Pt/tris(4-fosfonatofenil) fosfina
Reacción de reducción de oxígeno
Kostelansky et al., 2006
Pt/derivado de poliestireno
Oxidación de alcoholes
Miyamura et al., 2007
METAL: ORO (Au)
Au/poli(metil metacrilato), poliestireno y polianilina como soporte
Decomposición de H2O2
Ishida et al., 2008
Au/poli(metil metacrilato)
Reducción de 4-nitrofenol
Kuroda et al., 2009
Au/microgel basedo en N,N- dimetilacrilamida
Oxidación de alcoholes
Biffis et al., 2005
Au/TiO2, CeO2, Al2O3 y SiO2
Reacción de “water gas shift”
Sandoval et al., 2007
Au/poli(vinilalcohol)
Oxidación de 1,2 dioles
Mertens et al., 2005
Au/CeO2, Al2O3, TiO2, MgO, carbón activado y SiO2
Síntesis de hidrógeno a través de la oxidación de metanol
Gazsi et al., 2009
Au/TiO2, MgO, Al2O3, CeO2 and C
Oxidación de compuestos benzílicos
Dapurkar et al., 2009
Au/hidrotalcita, MgO, Al2O3, TiO2, SiO2
Lactonización oxidativa de dioles
Mitsudome et al., 2009
Au/sílica mesoporosa
Deshidrogenación de etanol
Guan et al., 2009
Au/TiO2
Oxidación de metanol
Nuhu et al., 2007
Au/electrodo de ITO
Electroxidación de CO
Diao et al., 2009
Au/TiO2
Oxidación de óxido nítrico
Milsom et al., 2007
Au/PANI-injertado en MWCNT
Oxidación de metanol y CO
Santosh et al., 2006
Au/TiO2
Isomerización de epóxidos
Raptis et al., 2009
Au/CeO2, TiO2, MCM-41
Epoxidación de alquenos
Aprile et al., 2009
La forma de llevar a cabo las reacciones catalíticas en el caso de los nanocatalizadores ha sido largamente discutida y la discusión persistirá por mucho tiempo, pues su análisis no es trivial; sin embargo, con los estudios hechos hasta la fecha y en todos los ejemplos mostrados en la Tabla 2, se ha informado que funcionan como reservorios de los catalizadores “reales”, disolviéndolos en el medio y generando la catálisis homogénea para después reintegrarse al sistema nanoestructurado; puede ser generado a través de un compuesto organometálico, para generar nanopartículas y que de esta forma se integre al ciclo catalítico o participe directamente como catalizador heterogeneizado (Figura 4).
Discusión
Los nanocatalizadores pueden ser considerados como un polvo mágico, costosos debido principalmente a los procesos involucarados en su obtención y preservación. También, se deben considerar las condiciones de proceso en la industria y los desechos que pueden ser vertidos en el agua. En el caso de emplear nanocatalizadores, si los desechos tienen este mismo destino, resulta factible pensar que puedan generar daños aún mayores por su alta reactividad y capacidad de incluirse en los procesos bioquímicos de los seres vivos con los que tenga contacto. Debido a lo anterior, resulta atractivo el estudio de los procesos químicos, físicos y fisicoquímicos en los que se encuentran involucrados.
El costo/beneficio de los catalizadores se ve disminuido debido a las condiciones de almacenamiento y producción, pero podría ser aún más costoso el impacto medioambiental del uso en grandes escalas de algunos de estos nanomateriales. El tiempo que llevan en el planeta como una consecuencia de la producción humana es aún pequeño, comparado con los estudios que se realizan para evaluar los daños que puedan generar (reunión conjunta FAO/ OMS, 2011).
Es así, que entender, aprender y trasmitir el conocimiento relacionado con estos materiales es importante, pero emplearlos en gran escala requiere de un análisis que involucre el costo energético durante su producción (Stieberova et al., 2015) (Trierweiler et al., 2011), así como los efectos ambientales que se podrían estar generando (Shalhevet et al., 2009).
De momento, no existen estudios que contengan resultados concluyentes respecto a la ventaja obtenida al trabajar con los materiales en escalas nanométricas; no obstante, al comparar los precios de dos diferentes compuestos con rodio (el catalizador molecular de Wilkinson ((C6H5)3RhCl) con un costo de $1,882.001 pesos mexicanos por gramo; contra 1 gramo de nanopartículas de rodio soportadas sobre hidróxido de aluminio (NPs de Rh/ AlO(OH)), con un costo de $3,154.001 pesos mexicanos), observamos un diferencial cercano al 100%.
En mi grupo de trabajo hemos obtenido nanopartículas de metales del grupo del platino para generar catalizadores mediante procesos sencillos que involucren la menor cantidad de reactivos y disolventes, que no requieren de moléculas protectoras y, sin embargo, hemos encontrado que los resultados de las pruebas catalíticas han sido, en el mejor de los casos, comparables a las de los catalizadores de tipo organometálico del mismo metal (García et al., 2015; Redón et al., 2009, 2011 y 2015); lo que nos hace suponer un beneficio marginal al trabajar con estos sistemas en estos tamaños.
El estudio de los nanocatalizadores por el interés científico y entendimiento de los procesos y mecanismos de reacción siempre será invaluable, pero la aplicación industrial está lejos de llegar a ser beneficiosa. Si bien podrían parecer un polvo mágico que realice las mismas reacciones que sus equivalentes moleculares, con extraordinarios rendimientos, una menor contaminación y un menor costo de producción, aún nos encontramos en la búsqueda de ese catalizador o nanocatalizador ideal. Los procesos industriales actualmente están diseñados para trabajar con los catalizadores de tipo organometálico, por lo cual la implementación de plantas industriales que empleen nanopartículas en sus procesos requiere de inversiones adicionales.
Al respecto, existe un muy interesante artículo (Schoenberger, 2015) en el que se propone sustituir los nanocatalizadores de los convertidores catalíticos que actualmente se emplean en los automóviles, por materiales que no incluyan nanopartículas metálicas de metales del grupo del platino, argumentando la escasez y por ende el costo de estos metales. Curiosamente, dice el investigador proponente de esta innovación tecnológica, que será muy complicado convencer a los industriales para lograr cambiar esta situación, pero que se logrará en algún momento. Es decir, una de las innovaciones en las que se ha logrado el uso e industrialización de las nanopartículas metálicas del grupo del platino está a punto de ser eliminada, debido a su costo.
Sin embargo, si durante el estudio de los nanocatalizadores se encuentra(n) alguna(s) reacción(es) que no se puedan llevar a cabo con catalizadores de tipo organometálico o que no se encuentre en uso por la industria en el mercado, entonces, probablemente, el costo/beneficio llevará a que se pueda trabajar en grandes escalas con nanocatalizadores, que generen productos útiles, sin contaminación, para el beneficio de la humanidad.
Bibliografía
- Andrés, R., De Jesús E., Flores J. C. (2007). Catalysts based on palladium dendrimers. New J. Chem., vol. 31: 1161-1191. DOI: 10.1039/B615761K
- Aprile, C., Corma A., Domine M. E., García H., Mitchell C. (2009). A cascade aerobic epoxidation of alkenes over Au/CeO2 and Ti-mesoporous material by “in situ” formed peroxides. Journal of Catalysis, vol. 264: 44-53. DOI: 10.1016/j.jcat.2009.03.010.
- Araque, C. A., Fontal, B., Contreras, R. R., Bellandi, F., Parra, M. F., Vielma, J., Cardozo, E.J. (2013). Síntesis, caracterización e hidroformilación catalítica de 1-hexeno con nuevos sistemas híbridos: [Co2(CO)8] y [Co2(CO)6(PPh3)2] sobre SiO2 funcionalizada. Revista Ciencia e Ingeniería, vol. 34, núm. 1: 37-44.
- Asedobega-Nieto E., Bachiller-Baeza B., Kuvshinov D. G., García-García F. R., Chukanov E., Kuvshinov G. G., Guerrero-Ruiz A., Rodríguez-Ramos I. (2008). Effect of the carbon support nano-structures on the performance of Ru catalysts in the hydrogenation of paracetamol. Carbon, vol. 46: 1046-1052.
- Astruc D. (2007). Palladium nanoparticles as efficient green homogeneous and heterogeneous carbon−carbon coupling precatalysts: A unifying view. Inorganic Chemistry, vol. 46: 1884-1894.
- Astruc D., Lu F., Aranzaes J. R. (2005). Nanoparticles as recyclable catalysts: The frontier between homogeneous and heterogeneous catalysis. Angewandte Chemie International Edition, vol. 44: 7852-7872. DOI: 10.1002/anie.200500766.
- Axet M. R., Castillón S., Claver C., Philippot K., Lecante P., Chaudret B. (2008). Chiral diphosphite-modified rhodium(0) nanoparticles: Catalyst reservoir for styrene hydroformylation. Eur. J. Inorg. Chem., 3460-3466. DOI: 10.1002/ejic.200800421.
- Balint I., Miyazaki A., Aika K. (2002). The catalytic activity of alumina supported Ru nanoparticles for NO/CH4 reaction. Chemical Communications, 630-631. DOI: 10.1039/B110602N.
- Balint I., Miyazaki A., Aika K. (2003). The relevance of Ru nanoparticles morphology and oxidation state to the partial oxidation of methane. Journal of Catalysis, vol. 220: 74-83. DOI:10.1016/S0021-9517(03)00279-3.
- Balint I., Miyazaki A., Aika K., (2003). Chemical and morphological evolution of supported Ru nanoparticles during oxidative conversion of methane. React. Kinet. Catal. Lett, vol. 80, núm. 1: 81-87.
- Barthe L., Hemati M., Philippot K., Chaudret B., Denicourt-Nowicki A., Roucoux A. (2009). Rhodium colloidal suspension deposition on porous silica particles by dry impregnation: Study of the influence of the reaction conditions on nanoparticles location and dispersion and catalytic reactivity. Chem. Eng. J., vol. 151: 372-379. DOI:10.1016/j.cej.2009.03.051.
- Bhattacharjee S., Bruening M. L. (2008). Selective hydrogenation of monosubstituted alkenes by Pd nanoparticles embedded in polyelectrolyte films. Langmuir, vol. 24: 2916-2920.
- Bhattacharjee S., Dotzauer D. M., Bruening M. L. (2009). Selectivity as a function of nanoparticle size in the catalytic hydrogenation of unsaturated alcohols. J. Am. Chem. Soc., vol. 131: 3601-3610.
- Biffis A., Minati L. (2005). Efficient aerobic oxidation of alcohols in water catalysed by microgel-stabilised metal nanoclusters. Journal of Catalysis, vol. 236: 405-409. DOI: 10.1016/j.jcat.2005.10.012.
- Birss V. I., Andreas H., Serebrennikova I., Elzanowska H. (1999). Electrochemical characterization of sol‐gel formed Ir metal nanoparticles. Electrochem. Solid St., vol. 2: 326-329.
- Bond G. C., Thompson D. T. (1999). Catalysis by gold. Catalysis Review-Science Engineering, vol. 41: 319-388.
- Borsla A., Wilhelm A. M., Delmas H. (2001). Hydrogenation of olefins in aqueous phase, catalyzed by polymer-protected rhodium colloids: kinetic study. Catalysis Today, vol. 66: 389-395.
- Boujday, S., Blanchard, J., Villanneau, R., Krafft, J.-M., Geantet, C., Louis, C., Breysse, M., Proust, A. (2007). Polyoxomolybdate-stabilized Ru0 nanoparticles deposited on mesoporous silica as catalysts for aromatic hydrogenation. Chem. Phys. Chem., vol. 8: 2636-2642. DOI: 10.1002/cphc.200700533.
- Boutros M., Denicourt-Nowicki A., Roucoux A., Gengembre L., Beaunier P., Gédéon A., Launay F. (2008). A surfactant-assisted preparation of well dispersed rhodium nanoparticles within the mesopores of AlSBA-15: characterization and use in catalysis. Chemistry Communications, 2920-2922. DOI: 10.1039/B802548G.
- Boutros M., Launay F., Nowicki A., Onfroy T., Herledan-Semmer V., Roucoux A., Gédéon A. (2006). Reduced forms of Rh(III) containing MCM-41 silicas as hydrogenation catalysts for arene derivatives. Journal of Molecular Catalysis A-Chemistry, vol. 259: 91-98. DOI: 10.1016/j.molcata.2006.06.007.
- Bruss A. J., Gelesky M. A., Machado G., Dupont J. (2006). Rh(0) nanoparticles as catalyst precursors for the solventless hydroformylation of olefins. Journal of Molecular Catalysis A-Chemistry. 2006, vol. 252: 212-218. DOI: 10.1016/j.molcata.2006.02.063
- Bykov A., Matveeva V., Sulman M., Valetskiy P., Tkachenko O., Kustov L., Bronstein L., Sulman E., (2009). Enantioselective catalytic hydrogenation of activated ketones using polymer-containing nanocomposites. Catalysis Today, vol. 140: 64-69. DOI: 10.1016/j.cattod.2008.07.023.
- Caporusso A. M., Panziera N., Pertici P., Pitzalis E., Salvadori P., Vitulli G., Martra G. (1999). Hydrosilylation of aromatic nitriles promoted by solvated rhodium atom-derived catalysts. Journal of Molecular Catalysis A-Chemistry, vol. 150: 275-285. DOI: 10.1016/S1381-1169(99)00225-3
- Castillejos-López E., Maroto-Valiente A., Neviskaia D. M., Muñoz V., Rodríguez-Ramos I., Guerrero-Ruiz A. (2009). Comparative study of support effects in ruthenium catalysts applied for wet air oxidation of aromatic compounds. Catalysis Today, vol. 143: 355-363. ISSN 0920-5861.
- Chen C. W., Chen C. Y., Huang Y. H. (2009). Method of preparing Ru-immobilized polymer-supported catalyst for hydrogen generation from NaBH4 solution. International Journal of Hydrogen Energy, vol. 34: 2164-2173. DOI: 10.1016/j.ijhydene.2008.12.077.
- Choi M. K.-W., Yu W.-Y., So M.-H., Zhou C.-Y., Deng Q.-H., Che C.-M. (2008). A Non-Cross-Linked Soluble Polystyrene-Supported Ruthenium Catalyst for Carbenoid Transfer Reactions. Chem. Asian. J., vol. 3: 1256-1265. DOI: 10.1002/asia.200800144.
- Chun Y. S., Shin J. Y., Song C. E., Lee S.G. (2008). Palladium nanoparticles supported onto ionic carbon nanotubes as robust recyclable catalysts in an ionic liquid. Chem. Communications, 942-944.
- Cimpeanu V., Kočevar M., Parvulescu V. I., Leitner W. (2009). Preparation of rhodium nanoparticles in carbon dioxide induced ionic liquids and their application to selective hydrogenation. Angew. Chem. Int. Ed., vol. 48: 1085-1088. DOI: 10.1002/anie.200803773.
- Collier P. J., Iggo J. A., Whyman R. (1999). Preparation and characterisation of solvent-stabilised nanoparticulate platinum and palladium and their catalytic behaviour towards the enantioselective hydrogenation of ethyl pyruvate. J. Mol. Catal. A-Chem., vol. 146: 1999 149-157. ISSN 1381-1169.
- Cornejo, L. (2015). El porqué las diferentes propiedades de las nanopartículas en nuevas tecnologías y materiales. Nanotecnología, nuevos materiales de construcción, nuevas tecnologías en construcción de obras subterráneas. En <http://nuevastecnologiasymateriales.com/el-porque-las-diferentes-propiedades-de-las-nano-particulas/>. (Consultado el 4 de septiembre de 2015).
- Cunha D. S., Cruz G. M. (2002). Hydrogenation of benzene and toluene over Ir particles supported on γ-Al2O3. Applied Catalysis A. vol. 236: 55-66. DOI: 10.1016/S0926-860X(02)00275-2.
- Dapurkar S. E., Shervani Z., Yokoyama T., Ikushima Y., Kawanami H. (2009). Supported gold nanoparticles catalysts for solvent-free selective oxidation of benzylic compounds into ketones at 1 atm O2. Catal Letters, vol. 130: 42-47. DOI: 10.1007/s10562-009-9859-4.
- De Rogatis L., Montini T., Casula M. F., Fornasiero P. (2008). Design of Rh@ Ce0.2Zr0.8O2-Al2O3 nanocomposite for ethanol steam reforming. J. Alloys Compd., vol. 451: 516-520.
- Debecker D. P., Faure C., Meyre M.-E., Derré A., Gaigneaux E. M. (2008). A new bioinspired route to metal-nanoparticle-based heterogeneous catalysts. Small vol. 4, núm. 10: 1806-1812. DOI: 10.1002/smll.200800304.
- Demir M. M., Gulgun M. A., Menceloglu Y. Z., Erman B., Abramchuk S. S., Makhaeva E. E., Khokhlov A. R., Matveeva V. G., Sulman M. G. (2004). Palladium nanoparticles by electrospinning from poly(acrylonitrile-co-acrylic acid)-PdCl2 solutions. Relations between preparation conditions, particle size, and catalytic activity. Macromolecules, vol. 37: 1787-1792. DOI: 10.1021/ma035163x.
- Demir M. M., Uğur G., Gülgün M. A., Menceloğlu Y. Z. (2008). Glycidyl-methacry-late-based electrospun mats and catalytic silver nanoparticles. Macromol. Chem. Phys., vol. 209, 508-515. DOI: 10.1002/macp.200700544.
- Denicourt-Nowicki A., Ponchel A., Monflier E., Roucoux A. (2007). Methylated cyclodextrins: An efficient protective agent in water for zerovalent ruthenium nanoparticles and a supramolecular shuttle in alkene and arene hydrogenation reactions. Dalton Transactions, 5714-5719. DOI: 10.1039/B713989F.
- Denicourt-Nowicki A., Roucoux A., Wyrwalski F., Kania N., Monflier E., Ponchel A. (2008). Carbon-supported ruthenium nanoparticles stabilized by methylated cyclodextrins: A new family of heterogeneous catalysts for the gas-phase hydrogenation of arenes. Chem. Eur. J., vol. 14: 8090-8093. DOI: 10.1002/chem.200801323.
- Deutsch D. S., Lafaye G., Liu D., Chandler B., Williams C. T., Amiridis M. D. (2004). Decomposition and activation of Pt-dendrimer nanocomposites on a silica support. Catalysis Letters, vol. 97: 139-143.
- Diao P., Wang J., Zhang D., Xiang M., Zhang Q. (2009). The effect of halide ions on the electrooxidation of CO on gold particles supported by indium tin oxide. J. Electroanal. Chem., vol. 630: 81-90. DOI: 10.1016/j.jelechem.2009.03.001.
- Drelinkiewicz A., Knapik A., Stanuch W., Sobczak J., Bukowska A., Bukowski W. (2008). Diamine functionalized gel-type resin as a support for palladium catalysts: Preparation, characterization and catalytic properties in hydrogenation of alkynes. React. Func. Polym., vol. 68: 1652-1664. DOI: 10.1016/j.reactfunct-polym.2008.09.004.
- Du Y., Zhang W., Wang X., Ping Yang (2006). Preparation of platinum core-polyaryl ether aminediacetic acid dendrimer shell nanocomposite for catalytic hydrogenation of phenyl aldehydes. Catalysis Letters, vol. 107: 177-183. DOI: 10.1007/Ss10562-005-0001-y.
- Duan S., Khan M., Senkan S. (2007). High-throughput nanoparticle catalysis: partial oxidation of propylene. Comb. Chem. High T. Scr., vol. 10: 111-119. DOI: http://dx.doi.org/10.2174/138620707779940956.
- Durand J., Teuma E., Gómez M. (2008). An overview of palladium nanocatalysts: surface and molecular reactivity. European Journal of Inorganic Chemistry, 3577-3586. DOI: 10.1002/ejic.200800569.
- Ebert K., Bengtson G., Just R., Oehring M., Fritsch D. (2008). Catalytically active poly(amideimide) nanofibre mats with high activity tested in the hydrogenation of methyl-cis-9-octadecenoate. Appl. Catal. A-Gen., vol. 346: 72-78. DOI:10.1016/j.apcata.2008.05.009.
- Esumi K., Isono R., Yoshimura T. (2004). Preparation of PAMAM− and PPI−metal (silver, platinum, and palladium) nanocomposites and their catalytic activities for reduction of 4-nitrophenol. Langmuir, vol. 20: 237-243. DOI: 10.1021/la035440t.
- Evangelisti C., Panziera N., Vitulli M., Pertici P., Balzano F., Uccello-Barretta Salvadori G., P. (2008). New monodispersed palladium nanoparticles stabilized by poly-(N-vinyl-2-pyrrolidone): Preparation, structural study and catalytic properties. Applied Catalysis A-Gen, vol. 339: 84-92. DOI:10.1016/j.jcat.2010.04.006.
- Farina V. (2004). High-turnover palladium catalysts in cross-coupling and heck chemistry: A critical overview. Adv. Synth. Catal., vol. 346: 1553-1582. DOI: 10.1002/adsc.200404178.
- Favier I., Teuma E., Gómez M. (2009). Palladium and ruthenium nanoparticles: Reactivity and coordination at the metallic surface. Chimie, vol. 12: 533-545. DOI: 10.1016/j.crci.2008.10.017.
- Fokema, M. D. Ying, J. Y. (1998). The selective catalytic reduction of nitric oxide with methane over scandium oxide, yttrium oxide and lanthanum oxide. Appl. Cataly. B-Environ., vol. 18: 71-77.
- Fonseca G. S., Silveira E. T., Gelesky M. A., Dupont J. (2005). Competitive hydrogenation of alkyl-substituted arenes by transition-metal nanoparticles: correlation with the alkyl-steric effect. Adv. Shynth. Catal., vol. 347: 847-853. DOI: 10.1002/adsc.200404387.
- Fonseca G. S., Umpierre A. P., Fichtner P. F. P., Teixeira S. R., Dupont J. (2003). The Use of imidazolium ionic liquids for the formation and stabilization of Ir0 and Rh0 nanoparticles: efficient catalysts for the hydrogenation of arenes. Chem. Eur., vol. 9: 3263-3269. DOI: 10.1002/chem.200304753.
- Fuchs M., Jenewein B., Pender S., Hayek K., Rupprechter G., Wang D., Schlögl R., Calvino J. J., Bernal S. (2005). Interaction of Pt and Rh nanoparticles with ceria supports: Ring opening of methylcyclobutane and CO hydrogenation after reduction at 373-723 K. Appl. Catal. A-Gen., vol. 294: 279-289. DOI: 10.1016/j.apcata.2005.07.043.
- Fukuoka A., Higashimoto N., Sakamoto Y., Inagaki S., Fukushima Y., Ichikawa M. (2001). Several factors affecting Al-MCM-41 synthesis. Micropor. Mesopor. Mat. vol. 48: 171-179.
- García-Peña, N. G., Caminade, A. M., Ouali, A., Turrin, C. O., Redón, R. (2015). Chemistry a European Journal, en prensa.
- García-Peña N. G., Redón R., Herrera Gómez A., Fernández Osorio A.L., Bravo-Sanchez M., Gomez-Sosa G. (2015). Solventless synthesis of ruthenium nanoparticles. Applied Surface Science, DOI: http://dx.doi.org/10.1016/j.apsusc.2015.02.186.
- Ganesan M., Freemantle R. G., Obare S. O. (2007). Monodisperse thioether stabilized palladium nanoparticles: Synthesis, characterization and reactivity. Chem. Mater., vol. 19: 3464-3471.
- Gazsi A., Bánsági T., Solymosi F. (2009). Hydrogen formation in the reactions of methanol on supported Au catalysts. Catalysis Letters, vol. 131: 33-41. DOI: 10.1007/s10562-009-0052-6.
- Gelesky M. A., Chiaro S. S. X., Pavan F. A., dos Santos J. H. Z., Dupont J. (2007). Supported ionic liquid phase rhodium nanoparticle hydrogenation catalysts. Dalton Trans, 5549-5553.
- Grass M. E., Joo S. H., Zhang Y., Somorjai G. A. (2009). Colloidally synthesized monodisperse Rh nanoparticles supported on SBA-15 for size and pretreatment-dependent studies of CO Oxidation. J. Phys. Chem. C. vol. 113: 8616-8623.
- Gual A., Axet M. R., Philippot K., Chaudret B., Denicourt-Nowicki A., Roucoux A., Castillon S., Claver C. (2008). Diphosphite ligands derived from carbohydrates as stabilizers for ruthenium nanoparticles: Promising catalytic systems in arene hydrogenation. Chemistry Communications, 2759-2761. DOI: http://dx.doi.org/10.1039/b802316f.
- Guan Y., Hensen E. J. M. (2009). Ethanol dehydrogenation by gold catalysts: The effect of the gold particle size and the presence of oxygen. Appl. Catal. A-Gen., vol. 361: 49-56.
- Gupta G., Stowell C. A., Patel M. N., Gao X., Yacaman M. J., Korgel B. A., Johnston K. P. (2006). Infusion of presynthesized iridium nanocrystals into mesoporous silica for high catalyst activity. Chemistry Materials, vol. 18: 6239-6249. DOI: 10.1021/cm0616681.
- Han D., Li X., Zhang H., Liu Z., Hu G., Li C. (2008). Asymmetric hydroformylation of olefins catalyzed by rhodium nanoparticles chirally stabilized with (R)-BINAP ligand. Journal of Molecular Catalysis, A-Chem, vol. 283: 15-22. DOI: 10.1016/j.molcata.2007.12.008.
- Harada T., Ikeda S., Hau Ng Y., Sakata T., Mori H., Torimoto T., Matsumura M. (2008). Rhodium nanoparticle encapsulated in a porous carbon shell as an active heterogeneous catalyst for aromatic hydrogenation. Advances in Functional Materials, vol. 18: 2190-2196. DOI: 10.1002/adfm.200701442.
- Harada T., Ikeda S., Miyazaki M., Sakata T., Mori H., M. Matsumura (2007). A simple method for preparing highly active palladium catalysts loaded on various carbon supports for liquid-phase oxidation and hydrogenation reactions. J. Mol. Catal. A- Chem. 268, 59-64. DOI: 10.1016/j.molcata.2006.12.010.
- Haruta, M., Kobayashi, T., Sano, H., Yamada, N. (1987). Novel gold catalysts for the oxidation of carbon monoxide at a temperature far below 0 °C. Chemistry Letters, 405-408.
- Hasik M., Turek W., Nyczyk A., Stochmal E., Bernasik A., Sniechota A., Soltysek A. (2009). Application of conjugated polymer-platinum group metal composites as heterogeneous catalysts. Catal. Lett., vol. 127: 304-311. DOI: 10.1007/s10562-008-9679-y.
- Ho C. M., Yu W.-Y., Che C.-M. (2004). Ruthenium nanoparticles supported on hydroxyapatite as an efficient and recyclable catalyst for cis-dihydroxylation and oxidative cleavage of alkenes. Angewante Chemie International Edition, vol. 43: 3303-3307. DOI: 10.1002/anie.200453703.
- Hoxha F., van Vegten N., Urakawa A., Krumeich F., Mallat T., Baiker A. (2009). Re-markable particle size effect in Rh-catalyzed enantioselective hydrogenations. Journal of Catalysis, vol. 261: 224-231.
- Hu Y., Yu Y., Hou Z., Li H., Zhao X., Feng B. (2008). Biphasic hydrogenation of olefins by functionalized ionic liquid-stabilized palladium nanoparticles. Adv. Synth. Catalysis, vol. 350: 2077-2085. DOI: 10.1002/adsc.200800290.
- Huang W., Kuhn J. N., Tsung C-K., Zhang Y., Habas S. E., Yang P., Somorjai G. A. (2008). Dendrimer templated synthesis of one nanometer Rh and Pt particles supported on mesoporous silica: Catalytic activity for ethylene and pyrrole hydrogenation. Nano Letters, vol. 8: 2027-2034. DOI: 10.1021/nl801325m.
- Hubert C., Denicourt-Nowicki A., Roucoux A., Landy D., Legar B., Crowyn G., Monflier E. (2009). Catalytically active nanoparticles stabilized by host-guest inclusion complexes in water. Chemistry Communications, 1228-1230.
- Ishida T., Kuroda K., Kinoshita N., Minagawa W., Haruta M. (2008). Direct deposition of gold nanoparticles onto polymer beads and glucose oxidation with H2O2. J. Colloid Interface Sci., vol. 323: 105-111. DOI: 10.1016/j.jcis.2008.02.046.
- Jacinto M. J., Kiyohara P. K., Masunaga S. H., Jardim R. F., Rossi L. M. (2008). Recoverable rhodium nanoparticles: Synthesis, characterization and catalytic performance in hydrogenation reactions. Applied Catalysis A - Gen, vol. 338: 52-57. DOI: 10.1016/j.apcata.2007.12.018.
- Jayamurugan G., Humees C. P., Jayaraman N. (2009). Preparation and catalytic studies of palladium nanoparticles stabilized by dendritic phosphine ligand-functionalized silica. Journal of Molecular Catalysis A-Chemistry, vol. 307: 142-148. DOI: 10.1016/j.molcata.2009.03.020.
- Jenewein B., Fuchs M., Hayek K. (2003). The CO methanation on Rh/CeO2 and CeO2/Rh model catalysts: a comparative study. Surf. Sci., vols. 532-535: 364-369. DOI: 10.1016/S0039-6028(03)00095-5.
- Jia X., Ma X., Wei D., Dong J., Qian W. (2008). Direct formation of silver nanoparticles in cuttlebone-derived organic matrix for catalytic applications. Colloid. Surface A, vol. 330: 234-240.
- Jolly, W. L. (1989). Modern Inorganic Chemistry. Singapore: McGraw-Hill International Editions.
- Kakade B. A., Sahoo S., Halligudi S. B., Pillai V. K. (2008). Highly selective catalytic hydrogenation of arenes using rhodium nanoparticles supported on multi-walled carbon nanotubes. Journal of Physical Chemistry C., vol. 112, núm. 35: 13317-13319. DOI: 10.1021/jp804843h.
- Kang J., Zhang S., Zhang Q., Wang Y. (2009). Ruthenium nanoparticles supported on carbon nanotubes as efficient catalysts for selective conversion of synthesis gas to diesel fuel. Angewandte Chemie International Edition, vol. 48: 2565-2568. DOI: 10.1002/anie.200805715.
- Kidambi S., Bruening M. L. (2005). Multilayered polyelectrolyte films containing palladium nanoparticles: Synthesis, characterization, and application in selective hydrogenation. Chem. Mater., vol. 17: 301-307. DOI: 10.1021/cm048421t.
- Kidambi S., Dai J., Li J., Bruening M. L. (2004). Selective hydrogenation by Pd nanoparticles embedded in polyelectrolyte multilayers. J. Am. Chem. Soc., vol. 126: 2658-2659. DOI: 10.1021/ja038804c.
- Knecht M. R., Weir M. G., Myers V. S., Pyrz W. D., Ye H., Petkov V., Buttrey Frenkel D. J., Crooks A. I., R. M. (2008). Synthesis and characterization of Pt dendrimer-encapsulated nanoparticles: effect of the template on nanoparticle formation. Chem. Mater., vol. 20: 5218-5228.
- Kostelansky C. N., Pietron J. J., Chen M.-S., Dressick W. J., Swider-Lyons K. E., Ramaker D. E., Stroud R. M., Klug C. A., Zelakiewicz B. S., Schull T. L. (2008). Triarylphosphine-stabilized platinum nanoparticles in three-dimensional nanostructured films as active electrocatalysts. Journal of Physical Chemistry B, vol. 110: 21487-21496. DOI: 10.1021/jp062663u.
- Kundu S., Ghosh S. K., Mandal M., Pal T. (2003). Reduction of methylene blue (MB) by ammonia in micelles catalyzed by metal nano particles. New. J. Chem., vol. 27: 656-662.
- Kuroda K., Ishida T., Haruta M. (2009). Reduction of 4-nitrophenol to 4-aminophenol over Au nanoparticles deposited on PMMA. Journal of Molecular Catalysis A-Chemistry, vol. 298: 7-11. DOI: doi:10.1016/j.molcata.2008.09.009.
- Lakshmi K. M., Sudarshan R. R., Pal U., Sreedhar B., Bhargava S. (2008). Transfer hydrogenation of carbonyl compounds catalyzed by ruthenium nanoparticles stabilized on nanocrystalline magnesium Oxide by Ionic Liquids. Advanced Synthesis Catalisys, vol. 350: 2231-2235. DOI: 10.1002/adsc.200800342.
- Lam V. W. S., Gyenge E. L. (2008). High-Performance Osmium Nanoparticle Electrocatalyst for Direct Borohydride PEM Fuel Cell Anodes. J. Electrochem. Soc., vol. 155: B1155-B1160.
- Lang H., May R. A., Iversen B. L., Chandler B. D. (2003). Dendrimer-encapsulated nanoparticle precursors to supported platinum catalysts. Journal of the American Chemical Society, vol. 125: 14832-14836. DOI: 10.1021/ja0364120.
- Larichev Y. V., Moroz B. L., Zaikovskii V. I., Yunusov S. M., Kalyuzhnaya E. Sur S., Bukhtiyarov V. B., V. I. (2007). XPS and TEM studies on the role of the support and alkali promoter in Ru/MgO and Ru−Cs+/MgO catalysts for ammonia synthesis. Journal of Physical Chemistry C., vol. 111: 9427-9436. DOI: 10.1021/jp066970b.
- Lee S.-S., Park B.-K., Byeo S.-H., F. Chand, H. Kim (2006). Chem. Mater. 18, núm. 24: 5631-5633.
- Léger B., Denicourt-Nowicki A., Olivier-Bourbigou H., Roucoux A. (2008). Rhodium nanocatalysts stabilized by various bipyridine ligands in nonaqueous ionic liquids: Influence of the bipyridine coordination modes in arene catalytic hydrogenation. Inorganic Chemistry, vol. 47: 9090-9096. DOI: 10.1021/ic8010713.
- Léger B., Denicourt-Nowicki A., Roucoux A., Olivier-Bourbigou H. (2008). Synthesis of bipyridine-stabilized rhodium nanoparticles in non-aqueous ionic liquids: A new efficient approach for arene hydrogenation with nanocatalysts. Advances in Synthesis Catalysis, vol. 350: 153-159. DOI: 10.1002/adsc.200700341.
- Léger B., Nowicki A., Roucoux A., Rolland J.-P. (2007). Competitive hydrogenation/ dehalogenation of halogenoarenes with surfactant-stabilized aqueous suspensions of rhodium and palladium colloids: A major effect of the metal nature. Journal of Molecular Catalysis A-Chemistry, vol. 266: 221-225. DOI:10.1016/j.molcata.2006.11.004.
- Li H., Wang R., Hong Q., Chen L., Zhong Z., Koltypin Y., Calderon-Moreno Gedanken J. A. (2004). Ultrasound-assisted polyol method for the preparation of SBA-15-supported ruthenium nanoparticles and the study of their catalytic activity on the partial oxidation of methane. Langmuir, vol. 20: 8352-8356. DOI: 10.1021/la049290d.
- Li J., Lin X. (2007). A composite of polypyrrole nanowire platinum modified electrode for oxygen reduction and methanol oxidation reactions. Journal of Electrochemical Society, vol. 154: B1074-B1079. DOI: 10.1149/1.2769820.
- Li J., Xu J., Dai W.-L., Fan K. (2009). Dependence of Ag deposition methods on the photocatalytic activity and surface state of TiO2 with twistlike helix structure. Journal of Physical Chemistry C. vol. 113: 8343-8349. DOI: 10.1021/jp8114012.
- Li X., Du Y., Dai J., Wang X., Yang P. (2007). Metal nanoparticles stabilized by cubic silsesquioxanes for catalytic hydrogenations. Catalysis Letters, vol. 118: núms. 1-2: 151-158. DOI : 10.1007/s10562-007-9142-5.
- Lin K.-J., Chen L.-J., Prasad M. R., Cheng C.-Y. (2004). Core-shell synthesis of a novel, spherical, mesoporous silica/platinum nanocomposite: Pt/PVP@MCM-41. Adv. Mater., vol. 16: 1845-1849.
- Liu M., Han M., Yu W. W. (2009). Hydrogenation of chlorobenzene to cyclohexane over colloidal pt nanocatalysts under ambient conditions. Environ. Sci. Technol., vol. 43: 2519-2524. DOI: 10.1021/es803471z.
- Liu P., Zhao M. (2009). Silver nanoparticle supported on halloysite nanotubes catalyzed reduction of 4-nitrophenol (4-NP). Appl. Surf. Sci., vol. 255: 3989-3993. DOI: 10.1016/j.apsusc.2008.10.094.
- Liu Z., Guo B., Chan S. H., Tang E. H., Hong L. (2008). Pt and Ru dispersed on LiCoO2 for hydrogen generation from sodium borohydride solutions. Journal of Power Sources, vol. 176: 306-311.
- Lu F., Liu J., Xu J. (2007). Synthesis of PVP-Ru amphiphilic microreactors with Ru nanocatalysts and their application in the fast hydrogenation of unsaturated compounds in aqueous media. Journal of Molecular Catalysis A-Chemistry, vol. 271: 6-13. DOI: 10.1016/j.molcata.2007.02.010.
- Mandal S., Roy D., Chaudhari R. V., Sastry M. (2004). Pt and Pd nanoparticles immobilized on amine-functionalized zeolite; excellent catalysts for hydrogenation and heck reactions. Chem. Mater., vol. 16: 3714-3724. DOI: 10.1021/cm0352504.
- Manikandan D., Divagar D., Sivakumar T. (2008). Selective hydrogenation of citral over noble metals intercalated montmorillonite catalysts. Catalysis Letters, vol. 123: 107-114.
- Marconi, G. Pertici, P. Evangelisti, C. Caporusso, A. M. Vitulli, G. Capannelli, G. Hoang, M. Turney, T. W. (2004). Nanostructured ruthenium on γ-Al2O3 catalysts for the efficient hydrogenation of aromatic compounds. Journal of Organo- metallic Chemistry, vol. 689: 639-646. DOI: 10.1016/j.jorganchem.2003.11.019.
- Marty J.-D., Martinez-Aripe E., Mingotaud A.-F., Mingotaud C. (2008). Hyper-branched polyamidoamine as stabilizer for catalytically active nanoparticles in water. Journal of Colloid Interface Science, vol. 326: 51-54.
- Mastalir Á., Rác B., Király Z., Molnár Á. (2007). In situ generation of Pd nanoparticles in MCM-41 and catalytic applications in liquid-phase alkyne hydrogenations. Journal of Molecular Catalysis A-Chemistry, vol. 264: 170-178.
- Mastalir A., Walter J., Notheisz F., Bartók M. (2001). Catalytic investigation of quasi-two-dimensional palladium nanoparticles encapsulated in graphite. Langmuir, vol. 17: 3776-3778. DOI: 10.1021/la001787+.
- Matveeva V., Bykov A., Doluda V., Sulman M., Kumar N., Dzwigaj S., Marceau E., Kustov L., Tkachenko O., Sulman E. (2009). Direct D-glucose oxidation over noble metal nanoparticles introduced on polymer and inorganic supports. Top Catal., vol. 52: 387-393.
- Meric P., Yu K. M. K., Tsang S. C. (2004). Molecular guided catalytic hydrogenation by micelle-hosted Pd nanoparticle in supercritical CO2. Catal. Lett., vol. 95, núms. 1-2: 39-43.
- Meric P., Yu K. M. K., Tsang S. C. (2004). Micelle-hosted palladium nanoparticles catalyze citral molecule hydrogenation in supercritical carbon dioxide. Langmuir, vol. 20: 8537-8545. DOI: 10.1021/la049549s
- Meric, P., Yu, K. M. K., Kong, A. T.S., Tsang, S. C. (2006). Pressure-dependent product distribution of citral hydrogenation over micelle-hosted Pd and Ru nanoparticles in supercritical carbon dioxide. Journal of Catalysis, vol. 237: 330-336. DOI: 10.1016/j.jcat.2005.11.010.
- Mertens P.G.N., Bulut M., Gevers L.E.M., Vankelecom I.F.J., Jacobs P.A., De Vos D.E. (2005). Catalytic oxidation of 1,2-diols to α-hydroxy-carboxylates with stabilized gold nanocolloids combined with a membrane-based catalyst separation. Catal. Lett., vol. 102: 57-61.
- Mévellec V., Roucoux A. (2004). Nanoheterogeneous catalytic hydrogenation of N-, O- or Sheteroaromatic compounds by reusable aqueous colloidal suspensions of rhodium(0). Inorg. Chim. Acta, vol. 357: 3099-3103.
- Mévellec V., Roucoux A., Ramirez E., Philippot K., Chaudret B. (2004). Adv. Surfactant-Stabilized Aqueous Iridium(0) Colloidal Suspension: An Efficient Reusable Catalyst for Hydrogenation of Arenes in Biphasic Media. Synth. Catal., vol. 346: 72-76. DOI: 10.1002/adsc.200303157.
- Miao S., Liu Z., Han B., Huang J., Sun Z., Zhang J., Jiang T. (2006). Ru nanoparticles immobilized on montmorillonite by ionic liquids: A highly efficient heterogeneous catalyst for the hydrogenation of benzene. Angewandte Chemie International Edition, vol. 45: 266-269.
- Michels J. J., Huskens J., Reinhoudt D. N. (2002). Dendrimer-cyclodextrin assemblies as stabilizers for gold and platinum nanoparticles. Journal of Chemical Society, Perkin Transactions, vol. 2: 102-105. DOI: 10.1039/B108026A.
- Migowski P., Dupont J. (2007). Catalytic applications of metal nanoparticles in imidazolium ionic liquids. Chem. Eur. J., vol. 13: 32-39. DOI: 10.1002/chem.200601438.
- Milsom E. V., Novak J., Oyama M., Marken F. (2007). Electrocatalytic oxidation of nitric oxide at TiO2-Au nanocomposite film electrodes. Electrochemistry Communications, vol. 9: 436-442. DOI: 10.1016/j.elecom.2006.10.018.
- Mitsudome T., Arita S., Mori H., Mizugaki T., Jitsukawa K., Kaneda K. (2008). Supported silver-nanoparticle-catalyzed highly efficient aqueous oxidation of phenylsilanes to silanols. Angew. Chem. Int. Edition, vol. 47: 7938-7940. DOI: 10.1002/anie.200802761.
- Mitsudome T., Noujima A., Mizugaki T., Jitsukawa K., Kaneda K. (2009). Supported gold nanoparticles as a reusable catalyst for synthesis of lactones from diols using molecular oxygen as an oxidant under mild conditions. Green Chemiatry, vol. 11: 793-797. DOI: 10.1039/b900576e.
- Miyamura H., Matsubara R., Miyazaki Y., Kobayashi S. (2007). Aerobic oxidation of alcohols at room temperature and atmospheric conditions catalyzed by reusable gold nanoclusters stabilized by the benzene rings of polystyrene derivatives. Angewante Chemie-International Edition, vol. 46: 4151-4154. DOI: 10.1002/anie.200700080.
- Miyao T., Minoshima K., Naito S. (2005). Remarkable hydrogen occlusion ability of hollow Ir-SiO2 nanoparticles prepared by reversed micelle techniques. J. Mater. Chem., vol. 15: 2268-2270.
- Montini T., De Rogatis L., Gombac V., Fornasiero P., Graziani M. (2007). Rh(1%)@ CexZr1−xO2-Al2O3 nanocomposites: Active and stable catalysts for ethanol steam reforming. Appl. Catal. B-Environ., vol. 71: 125-134. DOI: 10.1016/j.apcatb.2006.09.003.
- Mu X., Meng J., Li Z., Kou Y. (2005). Rhodium nanoparticles stabilized by ionic copolymers in ionic liquids: long lifetime nanocluster catalysts for benzene hydrogenation. J. Am. Chem. Soc., vol. 127: 9694-9695.
- Murugadoss A., Chattopadhyay A. (2008). A ‘green’ chitosan-silver nanoparticle composite as a heterogeneous as well as micro-heterogeneous catalyst. Nanotechnology, vol. 19: 015603.
- Na Y., Park S., Han S. B., Han H., Ko S., Chang S. (2004). Ruthenium-catalyzed Hecktype olefination and Suzuki coupling reactions: Studies on the nature of catalytic species. Journal of the American Chemical Society, vol. 126: 250-258.
- Neumann R., Maayan G. (2005). Direct aerobic epoxidation of alkenes catalyzed by metal nanoparticles stabilized by the H~5PV~2Mo~1~0O~4~0 polyoxometalate. Chemistry Communications, 4595-4597. ISSN 1359-7345.
- Newton M. A., Dent A. J., Diaz-Moreno S., Fiddy S. G., Jyoti B., Evans J. (2006). Rapid monitoring of the nature and interconversion of supported catalyst phases and of their influence upon performance: CO oxidation to CO2 by γ-Al2O3 supported Rh catalysts. Chem. Eur. J., vol. 12: 1975-1985. DOI: 10.1002/chem.200500644.
- Niu Y., Yeung L. K., Crooks R. M. (2001). Size-selective hydrogenation of olefins by dendrimer-encapsulated palladium nanoparticles. J. Am. Chem. Soc., vol. 123: 6840-6846. DOI: 10.1021/ja0105257.
- Nowicki A., Mévellec V., Roucoux A., Dujardin C., Granger P., Payenb E., Philippot K. (2006). A simple and reproducible method for the synthesis of silica-supported rhodium nanoparticles and their investigation in the hydrogenation of aromatic compounds. New Journal of Chemistry, vol. 30: 1214-1219.
- Nowicki A., Zhang Y., Léger B., Rolland J.-P., Bricout H., Monflier E., Roucoux A. (2006). Supramolecular shuttle and protective agent: A multiple role of methylated cyclodextrins in the chemoselective hydrogenation of benzene derivatives with ruthenium nanoparticles. Chem. Commun., 296-298.
- Nuhu A., Soares J., Gonzalez-Herrera M., Watts A., Hussein G., Bowker M. (2007). Methanol oxidation on Au/TiO2 catalysts. Top. Catalysis, vol. 44: 293-297.
- Oh S.-K., Niu Y., Crooks R. M. (2005). Size-selective catalytic activity of Pd nanoparticles encapsulated within end-group functionalized dendrimers. Langmuir, vol. 21: 10209-10213. DOI: http://dx.doi.org/10.1021/la050524i.
- Ohde H., Ohde M., Wai C. M. (2004). Swelled plastics in supercritical CO2 as media for stabilization of metal nanoparticlesand for catalytic hydrogenation. Chemical Communications, 930-931. DOI: 10.1039/B311522D.
- Ohde H., Wai C. M., Kim H., Kim J., Ohde M. (2002). Hydrogenation of olefins in supercritical CO2 catalyzed by palladium nanoparticles in a water-in-CO2 microemulsion. Journal of the American Chemical Society, vol. 124: 4540-4541. DOI: 10.1021/ja012232j.
- Ohde M., Ohde H., Wai C. M. (2002). Catalytic hydrogenation of arenes with rhodium nanoparticles in a water-in-supercritical CO2 microemulsion. Chemical Communications, 2388-2389.
- Okamoto M., Fujigaya T., Nakashima N. (2009). Design of an assembly of polybenzimidazole, carbon nanotubes and Pt nanoparticles for a fuel cell electrocatalyst with an ideal interfacial nanostructure. Small, vol. 5: 735-740.
- Okitsu. K., Yue A., Tanabe S., Matsumoto H. (2000). Sonochemical preparation and catalytic behavior of highly dispersed palladium nanoparticles on alumina. Chem. Mater., vol. 12: 3006-3011.
- Ornelas C., Aranzaes J. R., Salmon L., Astruc D. (2008). “Click” dendrimers: Synthesis, redox sensing of Pd(OAc)2, and remarkable catalytic hydrogenation activity of precise Pd nanoparticles stabilized by 1,2,3-triazole-containing dendrimers. Chem. Eur. J., vol. 14: 50-64. DOI: 10.1002/chem.200701410.
- Ornelas C., Ruiz J., Salmon L., Astruc D. (2008). Sulphonated “click” dendrimer-stabilized palladium nanoparticles as highly efficient catalysts for olefin hydrogenation and suzuki coupling reactions under ambient conditions in aqueous media. Adv. Synth. Catal. vol. 350: 837-845. DOI: 10.1002/adsc.200700584.
- Ornelas C., Salmon L., Ruiz A. J., Astruc D. (2007). Catalytically efficient palladium nanoparticles stabilized by “click” ferrocenyl dendrimers. Chemical Communications, 4946-4948. DOI: 10.1039/B710925C.
- Özkar S., Finke R. G. (2005). Iridium(0) nanocluster, acid-assisted catalysis of neat acetone hydrogenation at room temperature: Exceptional activity, catalyst lifetime, and selectivity at complete conversion. J. Am. Chem. Soc., vol. 127: 4800-4808. DOI: 10.1021/ja0437813.
- Özkar S., Zahmakiran M. (2005). Hydrogen generation from hydrolysis of sodium borohydride using Ru(0) nanoclusters as catalyst. Journal of Alloy Compounds, vols. 404-406: 728-731.
- Pacheco Santos V., Del Colle V., Batista de Lima R., Tremiliosi-Filho G. (2007). In situ FTIR studies of the catalytic oxidation of ethanol on Pt(1 1 1) modified by bidimensional osmium nanoislands. Electrochim. Acta, vol. 52: 2376-2385. DOI: 10.1016/j.electacta.2006.08.044.
- Park I. S., Kwon M. S., Kang K. Y., Lee J. S., Park J. (2007). Rhodium and iridium nanoparticles entrapped in aluminum oxyhydroxide nanofibers: Catalysts for hydrogenations of arenes and ketones at room temperature with hydrogen balloon. Adv. Synth. Catal., vol. 349: 2039-2047. DOI: 10.1002/adsc.200600651.
- Park K. H., Jang K., Kim H. J., Son S. U. (2007). Near-monodisperse tetrahedral rhodium nanoparticles on charcoal: The shape-dependent catalytic hydrogenation of arenes. Angewante Chemie. International Edition, vol. 46: 1152-1155. DOI: 10.1002/anie.200603961.
- Pastoriza-Santos, I., Liz-Marzán, L. (2006). Tailoring the morphology and assembly of silver nanoparticles formed in DMF, en Nanoparticle assembles and superestructures, editado por Kotov, N. A. Boca Ratón, FL: Taylor & Francis Group: 525-526.
- Pellegatta, J.-L., Blandy, C., Collière, V., Choukroun, R., Chaudret, B., Cheng Philippot P., K. (2002). Catalytic investigation of rhodium nanoparticles in hydrogenation of benzene and phenylacetylene. Journal of Molecular Catalysis A-Chemistry, vol. 178: 55-61. DOI: 10.1016/S1381-1169(01)00298-9.
- Pelzer, K., Philippot, K., Chaudret, B., Meyer-Zaika, W., Schmidt G. (2003). Ruthenium nanoparticles in nanoporous alumina membranes: Preparation, characterization and catalytic properties. Z. Anorg. Allg. Chem., vol. 629: 1217-1222. DOI: 10.1002/zaac.200300042.
- Perkas N., Minh D. P., Gallezot P., Gedanken A., Besson M. (2005). Platinum and ruthenium catalysts on mesoporous titanium and zirconium oxides for the catalytic wet air oxidation of model compounds. Applied Catalysis B-Environmental, vol. 59: 121-130. DOI: 10.1016/j.apcatb.2005.01.009.
- Perkas N., Zhong Z., Chen L., Besson M., Gedanken A. (2005). Sonochemically prepared high dispersed Ru/TiO2 mesoporous catalyst for partial oxidation of methane to syngas. Catalysis Letters, vol. 103, núms. 1-2: 9-14. DOI: 10.1007/s10562-005-6496-4.
- Phan N. T. S., Van Der Sluys M., Jones C. W. (2006). On the nature of the active species in palladium catalyzed Mizoroki-Heck and Suzuki-Miyaura Couplings - homogeneous or heterogeneous catalysis, a critical review. Adv. Synth. Catal., vol. 348: 609-679. DOI: 10.1002/adsc.200505473.
- Piccolo L., Valcarcel A., Bausach M., Thomazeau C., Uzio D., Berhault G. (2008). Tuning the shape of nanoparticles to control their catalytic properties: selective hydrogenation of 1,3-butadiene on Pd/Al2O3. Phys. Chem. Chem. Phys., vol. 10: 5504-5506. DOI: 10.1039/B809651A.
- Pietrowski M., Zieliński M., Wojciechowska M. (2009). Selective reduction of chloronitrobenzene to chloroaniline on Ru/MgF2 catalysts. Catalysis Letters, vol. 128: 31-35.
- Pradhan N., Pal A., Pal T. (2002). Silver nanoparticle catalyzed reduction of aromatic nitro compounds. Colloid. Surface A, vol. 196: 247-257. DOI: 10.1016/S0927-7757(01)01040-8.
- Prechtl M. H. G., Scariot M., Scholten J. D., Machado G., Teixeira S. R., Dupont J. (2008). Nanoscale Ru(0) particles: Arene hydrogenation catalysts in imidazolium ionic liquids. Inorganic Chemistry, vol. 47 (19): 8995-9001. DOI: 10.1021/ic801014f.
- Puniredd S. R., Yin C. M., Hooi Y. S., Lee P.S., Srinivasan M.P. (2009). Dendrimer-encapsulated Pt nanoparticles in supercritical medium: Synthesis, characterization, and application to device fabrication. J. Colloid Interface Sci., vol. 332: 505-510. DOI: 10.1016/j.jcis.2009.01.011.
- Raptis C., Garcia H., Stratakis M. (2009). Selective isomerization of epoxides to allylic alcohols catalyzed by TiO2-supported gold nanoparticles. Angewante Chemical-International Edition, vol. 48: 3133-3136. DOI: 10.1002/anie.200805838.
- Raspolli Galletti, A. M., Antonetti, C., Giaiacopi, S., Antonetti, O., Giaiacopi, S., Piccolo, O., Venezia, A. M. (2009). Innovative process for the synthesis of nano-structured ruthenium catalysts and their catalytic performance. Top. Catal., vol. 52: 1065-1069. DOI: 10.1007/s11244-009-9254-9.
- Raspolli Galletti, A. M., Antonetti, C., Longo, I., Capannelli, G., Venezia, A. M. (2008). A novel microwave assisted process for the synthesis of nano-structured ruthenium catalysts active in the hydrogenation of phenol to cyclohexanone. Applied Catalysis A -Gen., vol. 350: 46-52. DOI: 10.1016/j.apcata.2008.07.044.
- Redel E., Krämer J., Thomann R., Janiak C. (2009). Synthesis of Co, Rh and Ir nanoparticles from metal carbonyls in ionic liquids and their use as biphasic liquid-liquid hydrogenation nanocatalysts for cyclohexene. Journal of Organometallics Chemistry, vol. 694: 1069-1075. DOI: 10.1016/j.jorganchem.2008.09.050.
- Redón, R., García-Peña, N. G., Ramírez-Crescencio (2014). Leaching in metal nanoparticle catalysis. Recent Patents on Nanotechnology, vol. 8, núm. 1: 31-51. DOI: 10.2174/1872210508999140130122644.
- Redón R., García-Peña N. G., Ugalde-Saldivar V. M., García J. J. (2009). Palladium-triazine aminoalcohol nanocomposite, its reactivity on Heck reaction. J. Mol. Catal. A-Chem ., vol. 300: 132-141. DOI: 10.1016/j.molcata.2008.10.052.
- Redón, R., García-Peña, N. G., Ramírez-Crescencio, F. (2011). Metallic nanoparticles nanocomposites: Their catalytic applications. En Andrew C. Poehler (ed.) Homogeneous catalysts. Types, reactions and applications. Nueva York: Nova Science Publishers, Inc.
- Redón R., Rendón-Lara, S.K., Fernández-Osorio, A.L., Ugalde-Saldivar V. M. (2011). Aerobic synthesis of palladium nanoparticles. Reviews on Advanced Materials Science, vol. 27: 31-42.
- Redón R., Ramírez F., Fernández A. L. (2011). Solventless synthesis of iridium(0) nanoparticles. Journal of Nanoparticle Research, vol. 13: 5959-5965. DOI: 10.1007/s11051-011-0413-0.
- Redón R., García-Peña, N.G., Ugalde-Saldivar, V. M., García, J.J. (2009). Palladium-triazine dendrimer nanocomposites, their reactivity on Heck reaction. Journal of Molecular Catalysis A: Chemical, vol. 300: 132-141.
- Reunión Conjunta FAO/OMS de expertos acerca de la aplicación de la nanotecnología en los sectores alimentario y agropecuario: posibles consecuencias para la inocuidad de los alimentos. Informe de la reunión, FAO y OMS (2011). Roma, Italia. ISBN 978-92-4-356393-0 (WHO) (NLM classification: QT 36.5) ISBN 978-92-5-306495-3 (FAO).
- Rodríguez-Gattorno G., Alemán-Vázquez L. O., Angeles-Franco X., Cano-Rodríguez J. L., Villagómez-Ibarra R. (2007). Cyclohexane ring opening on alumina-supported Rh and Ir nanoparticles. Energ. Fuel., vol. 21: 1122-1126. DOI: 10.1021/ef060084i.
- Rossi L. M., Machado G. (2009). Ruthenium nanoparticles prepared from ruthenium dioxide precursor: Highly active catalyst for hydrogenation of arenes under mild conditions. Journal of Molecular Catalysis A-Chemistry, vol. 298: 69-73. DOI: 10.1016/j.molcata.2008.10.007.
- Roucoux A., Schulz J., Patin H. (2003). Arene hydrogenation with a stabilised aqueous rhodium(0) suspension: A major effect of the surfactant counteranion. Advances in Synthesis Catalysis, vol. 345: 222-229. DOI: 10.1002/adsc.200390016.
- Ruta M., Laurenczy G., Dyson P. J., Kiwi-Minster L. (2008). Pd nanoparticles in a supported ionic liquid phase: Highly stable catalysts for selective acetylene hy-drogenation under continuous-flow conditions. J. Phys. Chem. C, vol. 112: 17814-17819. DOI: 10.1021/jp806603f.
- Sandoval A., Gómez-Cortés A., Zanella R., Díaz G., Saniger J. M. (2007). Gold nanoparticles: Support effects for the WGS reaction. Journal of Molecular Catalysis A-Chemistry, vol. 278: 200-208. DOI: 10.1016/j.molcata.2007.09.014.
- Santosh P., Gopalan A., Lee K.P. (2006). Gold nanoparticles dispersed polyaniline grafted multiwall carbon nanotubes as newer electrocatalysts: Preparation and performances for methanol oxidation. J. Catal., vol. 238: 177-185. DOI: 10.1016/j.jcat.2005.12.014.
- Schoenberger, R. (2015). Getting platinum out of catalytic converters. in Today´s Motor Vehicles, septiembre/octubre: 54-58
- Schulz J., Levigne S., Roucoux A., Patin H. (2002). Aqueous rhodium colloidal suspension in reduction of arene derivatives in biphasic system: A significant physico-chemical role of surfactant concentration on catalytic activity. Adv. Synth. Catal., vol. 344: 266-269. DOI: 10.1002/1615-4169(200206)344:3/4<266::AID-ADSC266>3.0.CO;2-O.
- Seetharamulu P., Kari K., Prasad Reddy, Padmasri A. H., Rama Rao K. S., David Raju B. (2009). Role of promoters on highly active nano-Ru catalyst supported on Mg-Al hydrotalcite precursor for the synthesis of ammonia. Catalysis Today, vol. 141: 94-98. DOI: 10.1016/j.cattod.2008.05.010.
- Semagina N., Joannet E., Parra S., Sulman E., Renken A., Kiwi-Minster L. (2005). Palladium nanoparticles stabilized in block-copolymer micelles for highly selective 2-butyne-1,4-diol partial hydrogenation. Appl. Catal. A-Gen., vol. 280: 141-147. DOI: 10.1016/j.apcata.2004.10.049.
- Semagina N., Kiwi-Minsker L. (2009). Palladium nanohexagons and nanospheres in selective alkyne hydrogenation. Catal. Lett., vol. 127: 334-338. DOI: 10.1007/s10562-008-9684-1.
- Semagina N., Renken A., Kiwi-Minsker L. (2007). Palladium nanoparticle size effect in 1-hexyne selective hydrogenation. J. Phys. Chem. C., vol. 111: 13933-13937. DOI: 10.1021/jp073944k.
- Semagina N., Renten A., Laub D., Kiwi-Minster L. (2007). Synthesis of monodispersed palladium nanoparticles to study structure sensitivity of solvent-free selective hydrogenation of 2-methyl-3-butyn-2-ol. J. Catal., vol. 246: 308-314. DOI: 10.1016/j.jcat.2006.12.011.
- Shalhevet, S., Haruvy,. N., Linkov, I., Steevens, J. (eds.). (2009) Methods of economic valuation of the health risks associated with nanomaterials. En Nanomaterials: Risks and benefits. NATO Advanced Research Workshop on Nanomaterials-Environmental Risk and Benefits Proceedings. Netherlands: Springer. 385-395.
- Somboonthanakij S., Mekasuwandumrong O., Panpranot J., Nimmanwudtipong T., Strobel R., Pratsinis S. E., Praserthdam P. (2007). Characteristics and catalytic properties of Pd/SiO2 synthesized by one-step flame spray pyrolysis in liquid-phase hydrogenation of 1-heptyne. Catal. Lett., vol. 119: 346-352. DOI: 10.1007/s10562-007-9242-2.
- Soo Park I., Serk Kwon M., Kim N., Sung Lee J., Yeon Kang K. (2005). Rhodium nanoparticles entrapped in boehmite nanofibers: Recyclable catalyst for arene hydrogenation under mild conditions. J. Park Chem. Communications, 5667-5669. DOI: 10.1039/B511577A.
- Soo Park I., Serk Kwon M., Yeon Kang K., Sung Lee J., Park J. (2007). Rhodium and iridium nanoparticles entrapped in aluminum oxyhydroxide nanofibers: Catalysts for hydrogenations of arenes and ketones at room temperature with hydrogen balloon. Advances. Synthesis Catalysis, vol. 349: 2039-2047. DOI: 10.1002/adsc.200600651.
- Spitaleri A., Pertici P., Scalera N., Vitulli G., Hoang M., Turney T. W., Gleria M. (2003). Supported ruthenium nanoparticles on polyorganophosphazenes: Preparation, structural and catalytic studies. Inorganica Chimica Acta, vol. 352: 61-71. DOI: 10.1016/S0020-1693(03)00141-5.
- Stieberova, B., Zilka, M., Ticha, M., Freiberg, F., Hosek, J. (2015). Comparative study of nanoparticle production technologies focused on environmental aspects. En NANOCON 2014, 6th International Conferences Proceedings. Czech Republic: Tanger Ltd., 701-706.
- Stowell C. A., Korgel B. A. (2005). Iridium nanocrystal synthesis and surface coating-dependent catalytic activity. Nano Letters, vol. 5: 1203-1207. DOI: 10.1021/nl050648f.
- Strbac S., Johnston C.M., Lu G.Q., Crown A., A. Wieckowski (2004). In situ STM study of nanosized Ru and Os islands spontaneously deposited on Pt(1 1 1) and Au(1 1 1) electrodes. Surf. Sci., 573, 2004 80-99. DOI: 10.1016/j.susc.2004.04.060.
- Su F., Lee F. Y., Lv L., Liu J., Tian X. N., Zhao X. S. (2007). Sandwiched ruthenium/ carbon nanostructures for highly active heterogeneous hydrogenation. Advances in Functional Materials, vol. 17: 1926-1931. DOI: 10.1002/adfm.200700067.
- Su, F., Lv, L., Lee, F. Y., Liu, T., Cooper, A. I., Zhao, X. S. (2007). Thermally reduced Ru nanoparticles as a highly active heterogeneous catalyst for the hydrogenation of monoaromatics. Journal of American Chemical Society, vol. 129: 14213-14223.
- Sun C., Peltre M. J., Briend M., Blanchard J., Fajewerg K., Krafft J.-M., Breysse M. (2003). Catalysts for aromatics hydrogenation in presence of sulfur: Reactivities of nanoparticles of ruthenium metal and sulfide dispersed in acidic Y zeolites. Applied Catalysis A-Gen vol. 245: 245-255. DOI: 10.1016/S0926-860X(02)00645-2.
- Takasaki M., Motoyama Y., Higashi K., Yoon S.H., Mochida I., Nagashima H. (2007). Ruthenium nanoparticles on nano-level-controlled carbon supports as highly effective catalysts for arene hydrogenation. Chem. Asian. J. vol. 2: 1524-1533. DOI: 10.1002/asia.200700175.
- Takasaki M., Motoyama Y., Yoon S.-H., Mochida I., Nagashima H. (2007). Highly efficient synthesis of optically pure 5,5‘,6,6‘,7,7‘,8,8‘-octahydro-1,1‘-bi-2-naphthol and -naphthylamine derivatives by partial hydrogenation of 1,1‘-binaphthyls with carbon nanofiber supported ruthenium nanoparticles. Journal of Organometallic Chemistry, vol. 72: 10291-10293. DOI: 10.1021/ jo702015j.
- Tao R., Miao S., Liu Z., Xie Y., Han B., An G., Ding K. (2009). Pd nanoparticles immobilized on sepiolite by ionic liquids: Efficient catalysts for hydrogenation of alkenes and Heck reactions. Green Chem., vol. 11: 96-101. DOI: 10.1039/B811587G.
- Taylor A. D., Sekol R. C., Kizuka J. M., D’Cunha S., Comisar C. M. (2008). Fuel cell performance and characterization of 1-D carbon-supported platinum nano-composites synthesized in supercritical fluids. Journal of Catalysis, vol. 259: 5-16. DOI: 10.1016/j.jcat.2008.01.032
- Tessonnier J.-P., Pesant L., Ehret G., Ledoux M. J., Pham-Huu C. (2005). Pd nanoparticles introduced inside multi-walled carbon nanotubes for selective hydrogenation of cinnamaldehyde into hydrocinnamaldehyde. Appl. Catal. A- Gen., vol. 288: 203-210. DOI: 10.1016/j.apcata.2005.04.034.
- Thiot C., Schmutz M., Wagner A., Mioskowski C. (2006). Polyionic Gels: Efficient heterogeneous media for metal scavenging and catalysis. Angewante Chemical International Edition, vol. 45: 2868-2871. DOI: 10.1002/anie.200504580.
- Tian D., Yong G., Dai Y., Yan X., Liu S. (2009). CO Oxidation Catalyzed by Ag/SBA-15 catalysts prepared via in situ reduction: The influence of reducing agents. Catalysis Letters, vol. 130: 211-216. DOI: 10.1007/s10562-009-9865-6.
- Trierweiler, L.F., Trierweiler, J.O., Beck, R., Guterres, S., Pohlmann, A. (eds.) (2011). Industrial production of polymeric nanoparticles: Alternatives and economic analysis. En Nanocosmetics and Nanomedicines: New Approaches for skin care. Berlín: Berlín Springer-Verlag: 123-138.
- Trzeciak A. M., Ziólkowski J. J. (2007). Monomolecular, nanosized and heterogenized palladium catalysts for the Heck reaction. Coordination Chemistry Reviews, vol. 251: 1281-1293. DOI: 10.1016/j.ccr.2006.11.013.
- Tuchbreiter L., Mecking S. (2007). Hydroformylation with dendritic-polymer-stabilized rhodium colloids as catalyst precursors. Macromol. Chem. Phys., vol. 208: 1688-1693. DOI: 10.1002/macp.200700198.
- Umpierre A. P., Machado G., Fecher G. H., Morais J., Dupont J. (2005). Selective Hydrogenation of 1,3-butadiene to 1-butene by Pd(0) nanoparticles embedded in imidazolium ionic liquids. Advances in Synthesis Catalysis, vol. 347: 1404-1412. DOI: 10.1002/adsc.200404313.
- Underhill R. S., Liu G. (2000). Preparation and Performance of Pd particles encapsulated in block copolymer nanospheres as a hydrogenation catalyst. Chem. Mater., vol. 12: 3633-3641. DOI: 10.1021/cm0005743.
- Valentine Rupa A., Manikandan D., Divagar D., Sivakumar T. (2007). Effect of deposition of Ag on TiO2 nanoparticles on the photodegradation of Reactive Yellow-17. J. Hazard. Mater., vol. 147: 906-913. DOI: 10.1016/j.jhazmat.2007.01.107.
- Van Leeuwen, P.W.N.M. (2004). Homogeneous catalysis. Understanding the art. Netherlands: Kluwer Academic Publishers.
- Vitulli G., Evangelisti C., Pertici P., Caporusso A. M., Panziera N., Salvadori P., Faga M. G., Manfredotti C., Martra G., Coluccia S., Balerna A., Colonna S., Mobilio S. (2003). Supported rhodium nanoparticles in catalysis: The role of stabilizers on catalytic activity and structural features. Journal of Organometallic Chemistry, vol. 681: 37-50. DOI: 10.1016/S0022-328X(03)00529-1.
- Wang Y., Zhang J., Wang X., Ren J., Zuo B., Tang Y. (2005). Metal nanoclusters stabilized with simple ions and solvents-Promising building blocks for future catalysts. Top. Catalysis, vol. 35: 35-41. DOI: 10.1007/s11244-005-3811-7.
- Xiao C.-X., Cai Z.-P., Wang T., Kou Y., Yan N. (2008). Acid initiation of ammonia-borane dehydrogenation for hydrogen storage. Angewandte Chemie International Edition, vol. 47: 746-749.
- Xu R., Wang D., Zhang J., Li Y. (2006). Shape-dependent catalytic activity of silver nanoparticles for the oxidation of styrene. Chem. Asian J., vol. 1: 888-893. DOI: 10.1002/asia.200600260.
- Yang C., Jiang H., Feng J., Fu H., Li R., Chen H., Li X., (2009). Asymmetric hydrogenation of acetophenone catalyzed by cinchonidine stabilized Ir/SiO2. Journal of Molecular Catalysis A-Chemistry, vol. 300: 98-102. DOI: 10.1016/j.molcata.2008.10.041.
- Yang P., Zhang W., Du Y., Wang X. (2006). Hydrogenation of nitrobenzenes catalyzed by platinum nanoparticle core-polyaryl ether trisacetic acid ammonium chloride dendrimer shell nanocomposite. J. Mol. Catal. A-Chem., vol. 260: 4-10. DOI: 10.1016/j.molcata.2006.06.045.
- Yang X., Yan N., Fei Z., Crespo-Quesada R. M., Laurenczy G., Kiwi-Minsker L., Kou Y., Li Y., Dyson P. J. (2008). Biphasic Hydrogenation over PVP Stabilized Rh nanoparticles in hydroxyl functionalized ionic liquids. Inorg. Chem., vol. 47: 7444-7446. DOI: 10.1021/ic8009145.
- Ye H., Crooks J. A., Crooks R. M. (2007). Effect of particle size on the kinetics of the electrocatalytic oxygen reduction reaction catalyzed by Pt dendrimer-encapsulated nanoparticles. Langmuir, vol. 23: 11901-11906. DOI: 10.1021/la702297m.
- Ye X.-R., Lin Y., Wang C.,. Engelhard M. H, Wang Y., Wai C. M. (2004). Supercritical fluid synthesis and characterization of catalytic metalnanoparticles on carbon nanotubes. J. Mater. Chem., vol. 14: 908-913. DOI: 10.1039/B308124A.
- Yin S.-F., Xu B.-Q., Ng C.-F., Au C.-T. (2004). Nano Ru/CNTs: a highly active and stable catalyst for the generation of COx-free hydrogen in ammonia decomposition. Applied Catalysis B-Environmental, vol. 48: 237-241. DOI: 10.1016/j.apcatb.2003.10.013.
- Yin S.-F., Xu B.-Q., Wang S.-J., Au C.-T. (2006). Nanosized Ru on high-surface-area superbasic ZrO2-KOH for efficient generation of hydrogen via ammonia decomposition. Applied Catalysis A-Gen. , vol. 301: 202-210. DOI: 10.1016/j.apcata.2005.12.005.
- Yinghuai Z., Chenyan K., Peng A. T., Emi A., Monalisa W., Louis L. K.-J., Hosmane N. S., Maguire J. A. (2008). Catalytic phenylborylation reaction by iridium(0) nanoparticles produced from hydridoiridium carborane. Inorganic Chemistry, vol. 47: 5756-5761. DOI: 10.1021/ic8000152.
- Yoo J. W., Hathcock D., El-Sayed M. A. (2002). Characterization of Pt nanoparticles encapsulated in Al2O3 and their catalytic efficiency in propene hydrogenation. J. Phys. Chem. A, vol. 106: 2049-2054. DOI: 10.1021/jp0121318.
- Yoon B., Kim H., Wai C. M. (2003). Dispersing palladium nanoparticles using a water-in-oil microemulsion-homogenization of heterogeneous catalysis. Chemical Communications, 1040-1041. DOI: 10.1039/B211836J.
- Yoon B., Pan H.-B., Wai C. M. (2009). Relative catalytic activities of carbon nanotube-supported metallic nanoparticles for room-temperature hydrogenation of benzene. Journal of Physical Chemistry C., vol. 113: 1520-1525. DOI: 10.1021/jp809366w.
- Yoon B., Wai C. M., (2005). Microemulsion-templated synthesis of carbon nanotube-supported Pd and Rh nanoparticles for catalytic applications. Journal of American Chemical Society, vol. 127: 17174-17175. DOI: 10.1021/ja055530f.
- Yung K.-F., Wong W.-T. (2007). Synthesis and catalytic studies of uniform Os & Os-Pd nanoparticles supported on MWNTs. J. Clust. Sci., vol. 18: 51-65. DOI: 10.1007/s10876-006-0079-4.
- Zhao C., Wang H., Yan N., Xiao C., Mu X., Dyson P. J., Kou Y. (2007). Ionic-liquid-like copolymer stabilized nanocatalysts in ionic liquids: II. Rhodium-catalyzed hydrogenation of arenes. Journal of Catalysis, vol. 250: 33-40. DOI: 10.1016/j.jcat.2007.05.014.
- Zhao M., Sun L., Crooks R. M. (1998). Preparation of Cu nanoclusters within den-drimer templates. J. Am. Chem. Soc. vol. 120: 4877. DOI: 10.1021/ja980438n.
- Zheng W., Zhang J., Xu H., Li W. (2007). NH3 decomposition kinetics on supported Ru clusters: Morphology and particle size effect. Catalysis Letters, vol. 119: 311-318. DOI: 10.1007/s10562-007-9237-z.
- Zhou, X., Wu, T., Hu, B., Jiang, T., Han, B. (2009). Ru nanoparticles stabilized by poly(N-vinyl-2-pyrrolidone) grafted onto silica: Very active and stable catalysts for hydrogenation of aromatics. Journal of Molecular of Catalysis A-Chemistry, vol. 306: 143-148. DOI: 10.1016/j.molcata.2009.03.002.
- Zhu Z.-Z., Wang Z., Li H.-L. (2008). Functional multi-walled carbon nanotube/polyaniline composite films as supports of platinum for formic acid electrooxidation. Appl. Surf. Sci., vol. 254: 2934-2940. DOI: 10.1016/j.apsusc.2007.10.033.
- Zuo B., Wang Y., Wang Q., Zhang J., Wu N., Peng L., Gui L., Wang X., Wang R., Yu D. (2004). An efficient ruthenium catalyst for selective hydrogenation of ortho-chloronitrobenzene prepared via assembling ruthenium and tin oxide nanoparticles. Journal of Catalysis, vol. 222: 493-498. DOI: 10.1016/j.jcat.2003.12.007.