www.mundonano.unam.mx | Mundo Nano
http://dx.doi.org/10.22201/ceiich.24485691e.2015.15.53886 | 8(15), 96-107, julio–diciembre 2015
Artículos de investigación
Las nanopartículas de oro de 20 nm inhiben la proliferación e invasión de células de carcinoma mamario humano MCF7, in vivo1
Roberto Lazzarini*
Omar Alcántar-Ramírez**
Ricardo Jaime-Cruz***
Esbeydy García-Monterrubio**
María Concepción Gutiérrez-Ruiz**
Luis Enrique Gómez-Quiroz**
* Departamento Biología de la Reproducción. Universidad Autónoma Metropolitana Iztapalapa (UAM-I). San Rafael Atlixco No. 186, Col. Vicentina, México D.F. Correspondencia: (lazzarini@xanum.uam.mx).
** Departamento Ciencias de la Salud, UAM-I.
*** Licenciatura en biología, UAM-I.
Resumen:
El cáncer de mama se posiciona como la neoplasia más común entre las mujeres a nivel mundial, haciendo importante la búsqueda de nuevos agentes que actúen contra esta enfermedad. La nanotecnología propone el uso de nanomateriales principalmente elaborados con oro (nanoAu). Ensayos in vitro sobre células tumorales indican que las nanoAu inducen su captación, eventualmente se dirigen cerca del núcleo celular y causan su fragmentación, produciendo la muerte de las células. Aunque los efectos de las nanoAu in vivo con modelo murino son prometedores, los altos costos y cuidados especiales de los animales (ratones desnudos) es un obstáculo para investigar este tema. La membrana corioalantoidea (CAM) del embrión de pollo es un modelo abordable y económico que permite imitar las condiciones microambientales de la mayoría de las neoplasias que afectan al hombre. El objetivo de este trabajo fue evaluar el efecto sobre la proliferación e invasión de las células de carcinoma mamario humano MCF7 en condiciones in vivo de la CAM del embrión de pollo. Nuestros resultados sugieren que las nanoAu pueden inhibir la proliferación de las células MCF7 y retrasan su diseminación sobre la CAM del embrión de pollo.
Palabras clave: nanopartículas de oro, cáncer de mama, xenoimplante, proliferación celular.
Abstract:
Breast cancer ranks as the most common malignancy among women worldwide, so it becomes important to search for new agents that act against the disease. Nanotechnology proposes the use of nanomaterials mainly made from gold (nanoAu). In vitro essays on tumor cells indicate that nanoAu induce uptake, possibly near the target cell nucleus and cause its fragmentation, resulting in cell death. Although the effects of nanoAu in vivo mouse model are promising, high costs and special care of animals (nude mice) is an obstacle to investigating this issue. The chorioallantoic membrane (CAM) of chick embryo is a robust economic model to mimic microenvironmental conditions of most tumors that affect humans. The aim of this study was to evaluate the effect on the proliferation and invasion of human breast carcinoma cells MCF7 in vivo chick embryo CAM conditions. Our results suggest that nanoAu can inhibit the proliferation of MCF7 cells and delay spread on the chick embryo CAM.
Keywords: gold nanoparticles, breast cancer, xenoimplant, cell proliferation.
Recibido: 7 de octubre de 2015.
Aceptado: 18 de octubre de 2015.
Introducción
El cáncer de mama es considerado un problema de salud pública en el mundo, es la neoplasia más frecuente en las mujeres a nivel mundial, aunque también puede presentarse en el hombre (Giordano et al., 2004). Las terapias antineoplásicas han demostrado mejorar la supervivencia en pacientes con cáncer de mama, pero también se caracterizan por presentar efectos secundarios potencialmente graves (Diest et al., 2004). Así, es imprescindible la búsqueda de nuevas terapias que permitan aumentar la esperanza y calidad de vida de las personas con esta enfermedad. La nanotecnología se posiciona como una opción, al proponer el suministro de fármacos con mayor eficacia contra varios tipos de cánceres humanos. Las nanoAu desnudas o asociadas a ligandos, se sugieren como uno de los productos nanotecnológicos más aptos como terapia contra el cáncer. Trabajos que han evaluado los efectos de las nanoAu sobre líneas celulares de las principales neoplasias humanas in vitro indican que las nanoAu son inicialmente endocitadas (Dam et al., 2012), en el citoplasma celular, incrementan las especies reactivas de oxigeno (Mateo et al., 2014), se desplazan selectivamente a la periferia del núcleo celular y producen daño al material genético, el núcleo pierde estructura (Dam et al., 2012) y, finalmente, las células cancerosas mueren por apoptosis (Kang et al., 2010; Selim y Hendi, 2012; Tsai et al., 2012; Chen et al., 2014). Sin embargo, las evaluaciones de los efectos anticarcinogénicos de las nanoAu en modelos in vivo, adquieren cada vez mayor relevancia. La membrana corioalantoidea del embrión de pollo (CAM) es un modelo abordable y económico que proporciona características microambientales muy similares a los tumores in situ de los humanos (Ossowski y Reich, 1980; Armstrong, 1982; Deryugina y Quigley 2008). La inhibición de la proliferación celular durante eventos carcinogénicos es de vital importancia y uno de los principales objetivos de la lucha contra el cáncer, por lo que propusimos evaluar el efecto de las nanoAu sobre la proliferación e invasión de células de carcinoma mamario humano MCF7 en un modelo in vivo de la CAM del embrión de pollo. En este estudio encontramos que las nanoAu disminuyeron significativamente la proliferación y relentizaron la invasión de las células de carcinoma mamario humano MCF7 en condiciones in vivo.
Materiales y métodos
Modelo de membrana corioalantoidea CAM
Se emplearon huevos fértiles de gallina (Gallus domesticus), libres de patógenos específicos, adquiridos en la granja ALPES S.A. (Tehuacán, Puebla). Se incubaron a 37.8 °C y a 60% de humedad, durante 7 días hasta obtener embriones en estadio 32HH de la clasificación de Hamburger y Hamilton (1952). Se hizo una ventana de aproximadamente 1 cm2 en los cascarones, disecamos la membrana del cascaron para exponer la CAM (Figura 1A), posteriormente se realizaron xenoimplantes utilizando colonias de células de carcinoma mamario humano MCF7 crecidas en Matrigel (BD Biosciences, USA) en presencia o no de nanoAu de 20 nm (Figura 1B y C), posteriormente, se reincubaron los huevos con los xenoimplantes, en las mismas condiciones iniciales por 4 días, para finalmente disecar la CAM con los xenoimplantes (Figura 1D).
Figura 1 Modelo de membrana corioalantoidea. A y B muestran las diferentes estructuras internas del embrión de pollo de 7 días de incubación. En B, se esquematiza el procedimiento para sembrar el xenoimplante. C, vista superior representativa de un xenoimplante formado con 1 × 106 células de carcino mamamario humano MCF7, embebidas en MatrigelTM y adicionadas con 10μl de nanopartículas de oro de 20 nm. Con líneas punteadas se realzaron digitalmente sus bordes. Los vasos sanguíneos se encuentran inmersos en la membrana corioalantoidea (imperceptible en C y D). D. Aspecto del xenoimplante después de cuatro días de re-incubación de los huevos. Abreviatura: Vs = vaso sanguíneo.

Fuente: Elaboración propia.
Cultivo celular, trazado y formación de tumoraciones para xenoimplante
Para hacer los xenoimplantes utilizamos la línea celular de carcinoma mamario humano MCF7, las cultivamos en medio DMEM adicionado con 10% de suero fetal bovino y 1% de antibiótico, a 37 °C y atmosfera con 5% CO2. Una vez alcanzada una confluencia celular del 80%, las células fueron trazadas con Lysotreaker® Red (LTR) (Invitrogen, USA) por 30 min. Más adelante, hicimos lavados con búfer de fosfatos, las células se recuperaron de las cajas de cultivo, se centrifugaron a 3,500 rpm, y se procedió a sembrar 1 × 106 células MCF7 en 30 µl de MatrigelTM. En 5 xenoimplantes MCF7/MatrigelTM se adicionó 10 µl de nanoAu de 20 nm [6.59 × 109 nanoAu/mL] (Sigma-Aldrich No. 753610), se consideró como el grupo de exposición. El grupo control se conformó con 5 xenoimplantes de MCF7/MatrigelTM. Posteriormente, se colocaron los xenoimplantes en CAMs independientes, como se muestra en la Figura 1C.
Inmunodetección
Una vez transcurrido el tiempo de exposición, se disecó la CAM con los xenoimplantes y fueron inmediatamente fijados con una solución al 4% de formaldehido en búfer de fosfatos por 24 h, después, los tejidos se deshidrataron y los incluimos en parafina, se realizaron cortes coronales de 5 µm mediante micrótomo (Leica, Alemania), y se montaron en portaobjetos electrocargados. Las muestras se rehidrataron y se hizo recuperación de antígenos con búfer de citratos (BioGenex, USA) en autoclave a 15 lb de presión por 5 min y, finalmente, se adicionó anticuerpos anti-Ki-67 (ABCam, UK) y anti-β-catenina (Santacruz, EU) en concentración 1/200, las muestras se incubaron toda la noche a 4 °C. Una vez trascurrido el tiempo de incubación, tratamos las muestras con anticuerpo secundario Alexa Fluor 488 anti-rabbit (Life Technology, USA) por 1 h a temperatura ambiente, los núcleos celulares se tiñeron con ioduro de propidio y/o DAPI (Santacruz, USA) diluidos 1/1000. Por último, las muestras se montaron y se observaron en un microscopio confocal LSM 780 NLO (Carl Zeiss, Alemania). Se obtuvieron microfotografías panorámicas compuestas de la CAM/xenoimplante con aumento de 10X (software, ZEN 2010). Se procesaron microfotografías con aumento 40X de las distintas zonas histológicas de las muestras.
Análisis de los datos
Para la cuantificación de células en proliferación, se utilizó el software Image J. Los datos están representados como promedio, desviación estándar, y se realizó el análisis de varianza (ANOVA) para comparación entre grupos. Los valores de significancia los calculamos por la prueba t de Student con valor p < 0.05.
Resultados y discusión
El modelo de la CAM del embrión de pollo nos permitió, de una manera rápida y económica, evaluar el efecto de las nanoAu sobre células de carcinoma mamario humano MCF7 in vivo, como una alternativa al modelo murino, en el cual, los altos costos en la adquisición de los ratones nude (nu/nu), la manutención, los cuidados, instalaciones especiales que se requieren, así como el tiempo de crecimiento tumoral de 4-8 semanas (Fogh et al., 1977), son un impedimento para su utilización. La CAM del embrión de pollo es un modelo utilizado para el estudio de tumores y la metástasis desde principios del siglo pasado (Rous y Murphy, 1911). Los embriones de pollo, al presentar de manera temporal inmunodeficiencia natural, aceptan el trasplante de tejidos de diversas especies (xenoimplante). La CAM también presenta gran vascularización que permite el rápido crecimiento de los xenoimplantes de entre 2 y 5 días después de la implantación (Fidler, 1975).
Para evidenciar si las nanoAu de 20 nm interfieren en la proliferación y/o invasión de las células de carcinoma mamario humano MCF7, en condiciones in vivo, trazamos inicialmente las células MCF7 con Lysotreaker Red, formamos xenoimplantes con MatrigelTM, y les adicionamos o no, nanoAu de 20 nm; procesamos los tejidos para microscopía confocal y rastreamos la distribución de las células MCF7 en la CAM, asimismo, cuantificamos la proliferación celular con Ki-67 y mediante β-catenina e indagamos la integridad de la membrana peri-xenoimplante.
Características histológicas de la CAM/xenoimplante
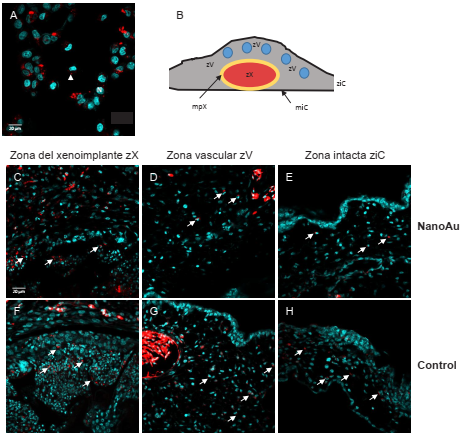
Encontramos que en todas las CAM/xenoimplantes del experimento se presentaron 4 zonas con características histológicas fácilmente diferenciables: 1. La membrana inferior (miC), compuesta de células propias de la CAM, con características endodérmicas y que separan la CAM del vitelo. 2. Una membrana peri-xenoimplante (mpX) formada por envolvimiento de las células de la membrana inferior de la CAM. 3. La zona propia del xenoimplante (zX). 4. La zona vascular (zV), rica en vasos sanguíneos y vasos aéreos. En la Figura 2B se muestra un esquema de las zonas histológicas que serán descritas en este trabajo.
Figura 2 Trazado, seguimiento y distribución histológica de las células de carcinoma mamario humano MCF7 en los xenoimplantes después de 4 días de re-incubación. El trazado celular se realizó en condiciones in vitro, como se muestra en A, la tinción roja en el citoplasma de las células corresponde a los lisosomas (cabeza de fecha), los núcleos celulares en color cyan. B. Esquema de la zonificación histológica que presentaron todos los xenoimplantes del experimento. De C a H, seguimiento de las células MCF7 trazadas, en todas las zonas histológicas de los xenoimplantes encontramos células MCF7. Abreviaturas N= Núcleo celular; miC= Membrana inferior de la CAM; mpX= Membrana peri-xenoimplante; zV= Zona vascular de la CAM; ziC= Zona intacta de la CAM.
Fuente: Elaboración propia.
Trazado y distribución de las células MCF7 en la CAM/xenoimplante
En la Figura 2A mostramos la tinción del trazado de las células MCF7 in vitro, se observa la característica tinción puntual color rojo proveniente de los lisosomas dentro del citoplasma de las células, la tinción roja del LTR no es uniforme en todo el citoplasma de las células. La distribución de las células MCF7 trazadas, tanto en los xenoimplantes tratados con nanoAu, como en los xenoimplantes control, mostró gran cantidad de células MCF7 en la zona del xenoimplante (zX) (Figura 2C y F) como era de esperarse; también las localizamos en la zona vascular (zV) (Figura 2D y G), incluso las rastreamos en zonas intactas de la CAM (ziC) muy alejadas del sitio original de la siembra del xenoimplante (Figuras 2E y H). El patrón de tinción del LTR no permite contabilizar el número de células MCF7 en las distintas zonas histológicas, sin embargo, estimamos que la presencia de células MCF7 en la zV y la ziC fue menor en el grupo de xenoimplantes tratados con nanoAu en comparación con los de control.
Proliferación celular
Se determinó el efecto de las nanoAu sobre la capacidad de proliferación de las células MCF7 por medio de la inmunodetección de Ki-67, marcador ampliamente utilizado en el cáncer de mama, al mostrar resultados similares con el índice mitótico y bromodesoxiuridina (Thor et al. , 1999). Encontramos un patrón distintivo en los xenoimplantes del grupo control, consistente en un “cinturón” de células MCF7 proliferantes, en la zX (Figura 3A y A1). Por el contrario, en los xenoimplantes del grupo tratado con nanoAu, ese carácter fue menos evidente (Figura 3B y B1). El “cinturón” de células en proliferación observado en el grupo control, lo encontramos en la porción inferior del xenoimplante, en vecindad con la miC; sin embargo, ésta no se encontraba presente (Figura 3A). Por otro lado, el vitelo del embrión de pollo es rico en nutrientes, pues proporciona los requerimientos necesarios para el crecimiento constante del embrión (Armstrong, 1982). Es probable que las células MCF7 de los xenoimplantes sin tratamiento, causaran la desintegración de la membrana basal entre las células de la miC, propiciando así, su desaparición. La pérdida de la miC permitió acceso directo a la gran cantidad de nutrientes del vitelo, lo cual podría favorecer la proliferación de las células MCF7; en contraparte, el grupo de xenoimplantes tratados con nanoAu, la miC, no sufrió cambios en su estructura (Figura 3B).
Figura 3 Proliferación celular. A y B microfotografías panorámicas compuestas de xenoimplantes con inmunodetección de Ki-67. En A xenoimplante control, se observa un prominente “cinturón” de células MCF7 en proliferación dentro de la zona del xenoimplante (cabeza de flechas), también hay abundante proliferación celular en la zona vascular; la membrana inferior de la CAM, esta ausente (*). B, xenoimplante con tratamiento de nanoAu, el “cinturón” proliferante es menos evidente; la proliferación de la zona vascular también es menor en comparación con A. A1 y B1, magnificación del “cinturón proliferante”. A2 y B2, magnificación de vasos sanguíneo, mostrando células MCF7 en proliferación. En C, grafica que muestra disminución en la proliferación en los xenoimplantes con tratamiento de nanoAu. C1, grafica de la proliferación en la vasculatura de los xenoimplantes.

Fuente: Elaboración propia.
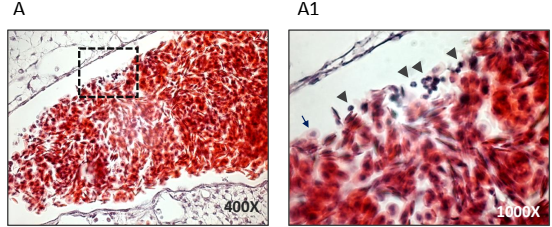
Posteriormente, cuantificamos la proliferación celular global entre ambos grupos del experimento; encontramos en el grupo de xenoimplantes tratados con nanoAu, una disminución significativa del 39.49%, de las células en proliferación en comparación con los xenoimplantes control (Figura 3A, B y C). También, comparamos la proliferación en la luz de los vasos sanguíneos y encontramos que, en los xenoimplantes del grupo con tratamiento de nanoAu, el número de células en proliferación disminuyó en 5 veces comparándolo con el grupo control (Figura 3C1). Generalmente, se considera que la proliferación celular tiene relación con la evolución clínica del cáncer de mama; así, el incremento de la actividad proliferativa se correlaciona fuertemente con mal pronóstico (Diest et al., 2004). Por lo tanto, uno de los grandes retos en el combate de esta enfermedad es bajar el índice de proliferación. Nuestros datos muestran que las nanoAu lograron bajar la proliferación en alrededor del 40% en comparación con los xenoimplantes sin tratamiento, incluso pudimos evidenciar que en los xenoimplantes tratados con nanoAu se registró también una menor actividad proliferante que pudiera provenir de células MCF7 que invadieron la vasculatura, desafortunadamente por microscopía confocal no fue posible identificar el trazador LTR en la luz vascular, debido, en parte, a que los eritrocitos emiten alta autoflorescencia al ser excitados con la línea láser que utilizamos para visualizar LTR; sin embargo, en muestras teñidas por la técnica de hematoxilina-eosina (HE), identificamos en la luz vascular células con forma redonda y el núcleo central, estas características no son propias de los eritrocitos de las aves (Figura 1 de datos suplementarios).
Figura 1 De datos suplementarios. Corte coronal de un xenoimplante del grupo control. Tinción de hematoxilina-eosina. A y A1, luz vascular de un xenoimplante, se observan algunas células redondas de escaso citoplasma y con un gran núcleo central (cabezas de flecha en A1), mismas que contrastan con las características propias de los eritrocitos de las aves. Abundante citoplasma aplanado y núcleo difuso (flecha azul en A1)
Fuente: Elaboración propia.
Pérdida de continuidad de la membrana peri-xenoimplante
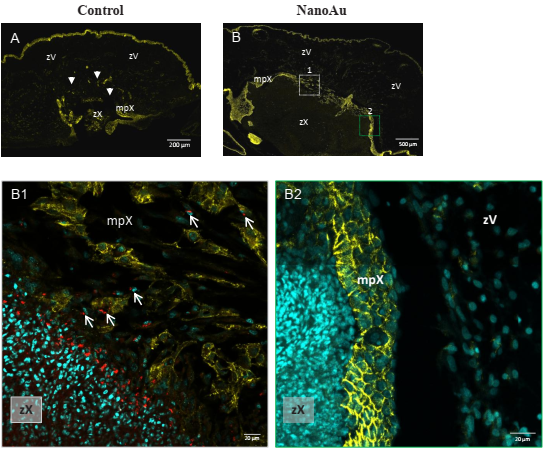
Derivado de observaciones de cortes histológicos teñidos por la técnica HE, observamos en algunas preparaciones, la aparente presencia de “puntos de fuga” en la mpX, lo que permitiría el paso de las células MCF7 entre la zX y la zV (datos no mostrados); dado lo anterior, hicimos inmunodetección de β-catenina para visualizar la estabilidad de las uniones entre las células que integran la mpX. Encontramos en los xenoimplantes del grupo control, grandes áreas con desintegración de la mpX (Figura 4A), incluso en algunos xenoimplantes, no fue posible distinguir el límite entre la zX de la zV, pensamos que la desintegración de la mpX permitió la invasión rápida y constante de las células MCF7 hacia la zV. Por el contrario en los xenoimplantes tratados con nanoAu, encontramos mayor integridad de la mpX; no obstante, evidenciamos segmentos de la mpX donde las células perdían las uniones entre ellas, a pesar de que aún se observa expresión cortical de β-catenina, sugiriendo que la formación de los “puntos de fuga” se debe a la pérdida de la membrana basal de las células de la mpX. En el momento que las células de la mpX perdieron su basamento, se alejaron unas de otras y permitieron la invasión de las células MCF7 hacia la zV de manera paulatina (Figura 4B y B1). A pesar de la presencia de los “puntos de fuga”, la contención de las células MCF7 dentro de la zX fue mayor en el grupo tratado con nanoAu que en los xenoimplantes control (comparar 3A con 3B, zX), información que puede estar relacionada con la disminución del conteo global de la proliferación de los xenoimplantes tratados con nanoAu, pues es probable que la invasión lenta desde la zX hacia la zV impactara en la cuantificación baja de la proliferación, ya que, por otro lado, la rápida invasión de las células MCF7 a la zV de los xenoimplantes sin tratamiento tuvo mejores condiciones microambientales para la proliferación. Se conoce que la invasión local de los tumores in situ depende de la degradación de las proteínas de las membranas basales, como colágeno tipo IV o V y proteólisis del colágeno intersticial tipo I, II o III presente en el tejido conjuntivo que rodea los tumores, la familia de las metalopeptidasas (MMP) son las responsables de este proceso, incluso se les considera como las principales mediadoras en las alteraciones observadas en el microambiente tumoral durante la progresión del cáncer (Rucci et al., 2011). Los niveles de expresión de las MMP están relacionados con la conducta invasora de los tumores (Vizoso et al., 2007); a pesar de que en nuestro estudio no indagamos el papel de las MMP, es conocido que las células MCF7 tienen alta expresión de la MMP-7, de la cual se puede utilizar su patrón de expresión para calcular la probabilidad de metástasis en el cáncer de mama (Jinga et al., 2006). En nuestro experimento fue posible observar dos comportamientos distintos en la desintegración de la mpX, incluso en algunos xenoimplantes sin tratamiento, la desintegración de la mpX fue total; en contraparte, en los xenoimplantes con nanoAu, la desintegración de la mpX se restringió a los “puntos de fuga”, por lo que es probable que en las nanoAu, al disminuir la proliferación de las células MCF7, su población fuera menor, retrasando de esta forma la invasión. También las nanoAu podrían haber interferido en la síntesis y/o liberación de las MMP-7 en condiciones in vivo y en conjunto retrasaron la degradación de la mpX.
Figura 4 Pérdida de continuidad de la membrana peri-xenoimplante. En A y B microfotografías panorámicas compuestas con inmunodetección de β-catenina de los xenoimplantes control y con tratamiento de nanoAu, respectivamente (se omitió la tinción nuclear). A, se observan evidentes áreas con desintegración la mpX (cabezas de flecha). B1 magnificación de un “punto de fuga” de un xenoimplante con tratamiento de nanoAu, las células de la mpX han perdido su basamento y comienzan a separarse unas de otras; permitiendo que las células MCF-7 trazadas invadan la zV rica en nutrientes (flechas cortas). B2 magnificación de una zona de la mpX del mismo xenoimplante, donde aun sus células no han perdido su membrana basal; la compartimentación entre la zX y la zV es evidente. Tinciones: núcleos celulares = cyan; β-catenina = amarillo; células MCF-7 trazadas = rojo. Abreviaturas: mpX = membrana peri-xenoimplante; zV= zona vascular; zX = zona del xenoimplante.
Fuente: Elaboración propia.
Conclusiones
En este trabajo mostramos que las nanoAu de 20nm son capaces de inhibir la proliferación así como retrasar la invasión de las células de carcinoma mamario humano MCF7 en un modelo tumoral in vivo.
Referencias
- Armstrong P, Quigley J, Sidebottom E. (1982). Transepithelial invasion and intramesenchymal infiltration of the chick embryo chorioallantois by tumor cell lines. Cancer Res., 42: 1826-1837.
- Chen, W., Lou, G., Xu, X. et al. (2014). Cancer-targeted functional gold nanopartcles for apoptosis induced and real-time imaging base don FRET. Nanoscale, 6(16): 9531-5.
- Dam, D., Lee, J., Sisco, P. et al. (2012). Direct observation of nanoparticles-cancer cell nucleus interactions. ACSNANO, vol. 6 núm. 4: 3318-3326.
- Deryugina, E. y Quigley, J. (2008) Chick embryo choriallantoic membrane model system to study and visualize human tumor cell metástasis. Histochem Cell Biol. Dec., 130(6): 1119-1130.
- Diest P, Wall E, Baak J. (2004). Prognostic value of proliferation in invasive brast cancer: review. J. Clin. Pathol., 57: 175-681.
- Fidler I. (1975). Biological behavior of malignant melanoma cells correlated to their survival in vivo. Cancer Res., 35: 218-224.
- Fogh J, Fogh J, Orfeo T. (1977). One hundred and twenty-seven cultured human tumor cell lines producing tumors in nude mice. J. Natl. Cancer Inst., 59: 221- 226.
- Giordano S, Cohen D, Buzdar A. et al. (2004). Breast carcinoma in men: A population based study. Cancer, 101: 51-57.
- Hamburger, B. y Hamilton, L. (1951). A series of normal stages in the development of the chick embryo. J. Morphol., 88: 49-92.
- Jinga D, Blidaru A, Condrea I. et al., (2006). MMP-9 and MMP-2 gelatinases and TIMP-1 and TIMP-2 inhibitors in breast cancer: Correlations with prognostic factors. J. Cell. Mol. Med., 10: 499-510.
- Kang, B., Mackey, M. y El-Sayed, M. (2010) Nuclear targeting of gold nanoparticles in cancer cells induces DNA damage, causing cytokinesis arrest and apoptosis. J. Am. Chem. Soc., 132(5): 1517-1519.
- Mateo, D., Morles, S., Ávalos et al. (2014). Oxidative stress cointrubutes to gold nanoparticle-induced cytotoxicity in human tumor cells. Toxicol Mech. methods, 24(3): 161-72.
- Ossowski L, y Reich E. (1980). Experimental model for quantitative study of metastasis. Cancer Res., 40: 2300-2309.
- Rous P. y J, Murphy (1911). Tumor implantations in the developing embryo. J. Am. Med. Assoc., 56: 741.
- Rucci N, Sanită P, Angelucci A. (2011). Expanding view of the tole of matrix metalloproteases in metastatic growth. Curr. Mol. Med., 42, 11: 609-22.
- Selim, M. y Hendi, A. (2012). Gold nanoparticles induce apoptosis in MCF-7 human breast cancer cells. Asian Pacific Journal of Cancer Prevention, vol. 13.
- Thor, A., Lui S, Moore H 2nd. et al. (1999). Comparison of mitotic index, in vitro bromodeoxyuridine labeling, and MIB-1 assays to quantitative proliferation in breast cáncer. J Clin. Oncol., 17: 470-7.
- Tsai, T., Hou, C., Wang, H. et al. (2012). Nucleocytoplasmatic transport blockage by SV40 peptide-modified gold nanoparticles induces cellular autophagy. International Journal of Nanomedicine, 7: 5214-5234.
- Vizoso F, González L, Corte M. et al. (2007). Study of matrix metalloproteinases and their inhibitors in breast cancer. Br. J. Cancer., 96: 903-11.