www.mundonano.unam.mx | Mundo Nano
http://dx.doi.org/10.22201/ceiich.24485691e.2017.19.57559 | 10(19), 7-25, julio–diciembre 2017
Artículos
Cristales líquidos liotrópicos. Nanoestructuras biomiméticas para uso tópico medicinal
Carlos T. Quirino-Barreda1,2 *
César Gazga-Urioste1,2
José J. Juárez-Sandoval1,2
Abraham Faustino-Vega3
Norma A. Noguez-Méndez1,2
Susana A. Macín-Cabrera4
Virginia E. Melo-Ruíz1
1 Laboratorio de Farmacia Molecular y Liberación Controlada. Departamento de Sistemas Biológicos, Universidad Autónoma Metropolitana-Xochimilco (UAM-X).
2 Programa de Maestría en Ciencias Farmacéuticas. División de Ciencias Biológicas y de la Salud. UAM-X.
3 Catedrático CONACyT. Proyecto 2863, con adscripción a la UAM-X.
4 Departamento de Atención a la Salud. UAM-X. Calzada del Hueso 1100. Colonia Villa Quietud. Coyoacán. Ciudad de México. 04960 México.
* Autor para correspondencia: (ctquirino@gmail.com); (cquirino@correo.xoc.uam.mx).
Resumen:
La piel es el órgano humano más grande, destacando su actividad de barrera, que abarca la protección a variaciones de temperatura y radiaciones, así como a la penetración de microrganismos patógenos y de sustancias orgánicas e inorgánicas capaces de producir enfermedad cutánea o sistémica. Su amplia superficie representa también un enorme potencial para la administración de diversas sustancias con fines locales y sistémicos; de ahí la tendencia actual en tecnología y nanotecnología farmacéutica por diseñar sistemas innovadores de uso tópico y transdérmico que mimetizando componentes de la piel persiguen incrementar la capacidad para entregar fármacos y biomoléculas con mayor eficacia y seguridad que la representada por otras vías y formas de dosificación.
Este artículo hace una somera exposición de los avances en el conocimiento de la estructura y función de barrera de la piel, subrayando la composición y propiedades mesofásicas de los lípidos intercelulares que controlan la difusión de moléculas a través de la epidermis; motivo por el cual son referente para el diseño de medicamentos tópicos bioinspirados en ellos, como es el caso de los cristales líquidos liotrópicos y algunas dispersiones de éstos como los cubosomas y hexosomas.
Palabras clave: Cristales liquidos, cubosomas, hexosomas, ketoconazol, piel, uso tópico.
Abstract:
Skin is the largest human organ, highlighting its barrier activity, covering protection to temperature variations and radiation, as well as the penetration of pathogenic microorganisms and organic or inorganic compounds capable of producing cutaneous or systemic diseases. Its wide surface also represents enormous potential for the administration of various substances with local and systemic purposes; hence the current trend in pharmaceutical technology and nanotechnology to design innovative systems for topical and transdermal use, mimicking skin components which seeks to increase the ability to deliver drugs and biomolecules with greater efficacy and safety than that represented by other routes and current dosage forms.
This article outlines the progress in the knowledge of the structure and function of skin barrier, highlighting the mesophase composition and properties of the intercellular lipids that control the diffusion of molecules through the epidermis; reason why are concerning topical medications bioinspired in dermal properties and its structures, such as lyotropic liquid crystals and their dispersions as cubosomes and hexosomes.
Keywords: Liquid crystals, cubosomes, hexosomes, ketoconazole, skin, topical use.
Recibido: 13 de junio de 2016.
Aceptado: 26 de septiembre de 2016.
Introducción
La piel, cuero cabelludo y mucosas, incluyendo la conjuntival, nasal, bucal, rectal y urogenital, así como el pelo, folículos pilosos, glándulas sudoríparas, sebáceas y uñas, constituyen el denominado sistema tegumentario o tejido cutáneo, que actúa como órgano sensorial teniendo como principal función la actividad de barrera biológica y mecánica ante distintos agentes y estímulos físicos, químicos y biológicos provenientes en general del medio ambiente. Este complejo sistema tiene asimismo actividades de síntesis (vitamina D, por ejemplo) y desde el nacimiento de los individuos, es colonizado por microrganismos que constituirán su flora normal; siendo este conjunto de células y moléculas propias y externas las que controlan la homeostasis y la sana relación del organismo con su entorno. Cualquier cambio puede dar lugar a trastornos y enfermedades sobre este tejido que, de no ser atendidas adecuadamente, pueden dar lugar a patologías que pueden complicarse a nivel sistémico (Magaña y Magaña, 2003; Menon et al., 2012; Vélez et al., 2009).
Es así que el mayor conocimiento de la estructura y función de barrera de la piel, particularmente de las propiedades mesofásicas de los lípidos intercelulares que controlan primordialmente la difusión de las moléculas a través de la epidermis, han dado lugar al desarrollo de materiales nanotecnológicos dérmicos bioinspirados en la matriz lipídica intercelular, como es el caso de los cristales líquidos liotrópicos y algunas dispersiones nanoestructuradas de éstos, como los cubosomas y hexosomas, los cuales muestran un comportamiento térmico biomimético al de los lípidos intercelulares de la piel, así como una permeación y retención epidérmica que les otorga gran potencial para uso tópico.
La estructura de la piel y la administración tópica
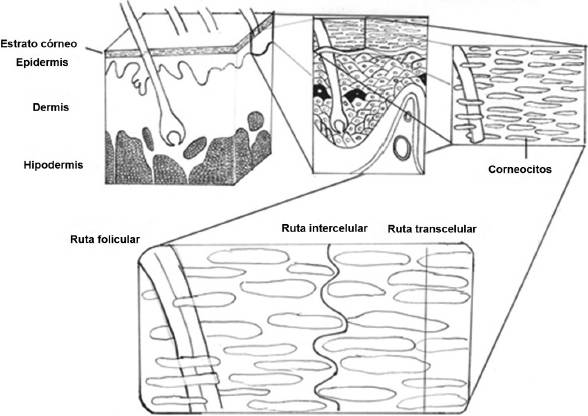
La piel es un órgano con varias franjas o estructuras laminares: epidermis y dermis, así como tejido graso subcutáneo (Figura 1). La primera es la capa más externa y se divide a su vez en otros cuatro estratos: basal, espinoso, granuloso y córneo, en ese orden interno hacia el exterior; mismas que a su vez se pueden distinguir entre otras propiedades, por el desempeño que tienen en la diferenciación secuencial de las principales células constituyentes: los queratinocitos; formando éstos, una vez conseguida su modificación final a corneocitos, el estrato córneo (EC). Esta capa se conforma de una matriz de corneocitos y lípidos extracelulares que los rodean, actuando como la primera barrera a la penetración de toda molécula y microrganismo (Menon et al., 2012).
Figura 1 Esquema simplificado de los principales estratos y apéndices de la piel. Se destaca al centro, la organización tipo ladrillo (corneocito) y cemento (matriz lipídica intercelular) del estrato córneo y las tres principales rutas de difusión molecular.
La administración tópica o cutánea es la aplicación de una composición farmacéutica sobre las capas más externas de la piel, principalmente el EC, cuero cabelludo y mucosas, así como pelo y uñas; su uso puede ser humano o veterinario. Estas formulaciones contienen en lo general uno o más fármacos cuyo propósito será resolver desórdenes cutáneos, manteniendo el efecto farmacológico en la superficie y/o dentro del área aplicada sin llegar al torrente circulatorio; siendo esto último lo que las diferencia de los sistemas transdérmicos (Menon et al., 2012; Bouwstra y Ponec, 2006).
Los medicamentos para uso tópico, así como los productos cosméticos y cosmecéuticos desarrollados hasta la fecha, se encuentran principalmente en forma de: solución, loción, emulsión (fluida, semisólida, múltiple, micrónica y submicrónica o nanométrica), ungüento, crema, pomada, gel, suspensión, espuma, pasta o aerosol; estando determinada la liberación del fármaco y su actividad local, por las propiedades tanto del vehículo o formulación, como de la molécula activa; además, el efecto local es regulado principalmente por el estrato córneo y en su caso, el cuero cabelludo, pelo y uñas, que en conjunto restringen la permanencia superficial de la composición farmacéutica, así como la completa difusión del fármaco en la zona de aplicación (Weiss, 2011).
La actividad local de las composiciones tópicas depende de la liberación inicial del activo desde la composición, así como de la permeación del activo a través de los primeros estratos de la piel y mucosas; realizándose este proceso principalmente mediante la difusión pasiva desde la superficie intacta del estrato córneo hacia las demás capas de la epidermis. Las rutas que pueden seguir las moléculas para su difusión en piel son primordialmente la transcelular e intercelular (Figura 1), ya que los apéndices de la piel (folículos pilosos y glándulas) representan sólo el 0.1% de la superficie de ésta (Moser et al., 2001).
La difusión pasiva de los fármacos por la piel también depende de las interacciones del activo y el vehículo con los principales componentes de la piel y mucosas (corneocitos y lípidos intercelulares); siendo considerada la difusión a través de los lípidos intercelulares (ruta intercelular) el mayor determinante de la velocidad de transporte percutáneo (Bowstra y Ponec, 2006; Moser et al., 2001; Trommer y Neubert, 2006). Asimismo, la limitación del paso de fármacos y otras moléculas a través de los corneocitos (ruta transcelular) se explica por la existencia de la envoltura lipoprotéica de los corneocitos, que minimiza el ingreso a estas células queratinizadas (Van Smeden et al., 2014).
Las estrategias para conseguir el efecto local esperado con las formulaciones tópicas han incluido: el aumento del tiempo de permanencia de la composición sobre la zona de interés, así como el desarrollo de matrices que controlan la liberación del fármaco. Para estos fines se han utilizado agentes viscosantes, gelificantes, oclusivos, promotores de la absorción, profármacos, liposomas, y nanopartículas (Fireman et al., 2011; Faustino-Vega y Quirino-Barreda, 2014). Estas últimas pueden ser partículas simples o estructuras complejas con un tamaño entre 1 y 1000 nm, las cuales suelen adoptar comportamiento coloidal, empleándose como adyuvantes o transportadores de uno o más fármacos, donde éste se encuentra disuelto, disperso, encapsulado, adsorbido y/o ligado. En cuanto a su estado físico o de agregación molecular, los sistemas nanoestructurados pueden estar en estado sólido, líquido, semisólido o mesofásico como es el caso de los cristales líquidos y dispersiones de éstos (Müller-Goymann, 2004; Faustino-Vega y Quirino-Barreda, 2014).
Los productos tópicos no sólo son los utilizados para conservar o restaurar el estado y funciones naturales del sistema tegumentario (Trommer y Neubert, 2006; Mugglestone et al., 2012), sino también los destinados a su limpieza, higiene e incluso la mejora o cambio de apariencia o de condiciones morfofisiológicas y funcionales a las que posee en su estado natural o actual, como son: cambios de coloración, humectación, plasticidad y otros que reducen los efectos de su envejecimiento; el control de los efectos de radiaciones como las de la luz solar, así como de desórdenes de la actividad metabólica y crecimiento de las células, que bajo ciertas circunstancias derivan en patologías como dermatitis, acné, eczema, psoriasis y diversos cánceres de piel y mucosas.
Las composiciones farmacéuticas tópicas también incluyen las que se destinan al combate de diversos microrganismos (bacterias, hongos, virus, protozoarios, entre otros) e incluso insectos que en el hombre y animales ocasionan distintas enfermedades o estados patológicos, tanto en la superficie como en los demás estratos del sistema tegumentario y sus apéndices. Para el caso particular de mucosas, como la vaginal, también se contempla el uso de composiciones tópicas auxiliares, como ocurre con la terapia hormonal, la atropia vulvovaginal y urogenital, aplicación de anticonceptivos y espermicidas; para la mucosa bucal, existen composiciones tópicas destinadas a la anestesia local y la antisepsia, entre otras. En este último caso, como ha ocurrido con cosméticos como champús, aunque para otros fines, el perfeccionamiento de las formulaciones tópicas bucales para conseguir el efecto local esperado, particularmente el antimicrobiano, ha incluido desde hace varias décadas, el uso de composiciones con un comportamiento líquido cristalino (Norling et al., 1992; Herman, 2010; Zhang y Liu, 2013).
Los lípidos intercelulares. Estructuras mesofásicas que regulan la permeación de fármacos en piel
Si bien desde la perspectiva de la tecnología farmacéutica es importante controlar la difusión del fármaco a través de las propiedades fisicoquímicas correspondientes al fármaco y al vehículo; en gran medida el proceso de difusión es regulado por la composición específica de los lípidos intercelulares del EC que rodean a los corneocitos, así como su excepcional arreglo matricial líquido cristalino (Moser, 2001; Trommer y Neubert, 2006; Van Smeden et al., 2014). Esta matriz lipídica intercelular es una bicapa que, rodeando a los corneocitos, conforma una estructura similar a una pared de ladrillo y cemento conocida también como modelo de mosaico fluido (Figura 1), donde los corneocitos son los ladrillos y los lípidos intercelulares el cemento (Kalinin et al., 2001; Moser, 2001; Bouwstra y Ponec, 2006; Trommer y Neubert, 2006; Hitesh et al., 2011; Sinkó et al., 2012; Van Smeden et al., 2014). Los corneocitos son células planas no viables llenas de agua y microfibrillas de queratina rodeadas de una doble envoltura lipoprotéica, siendo la primera la envoltura cornificada, consistente de una capa densa y entrecruzada de proteínas, entre ellas: filagrina, loricrina e involucrina; siendo la esterificación de esta última lo que la une con la subsecuente capa de lípidos no polares (ceramidas hidroxiladas y ácidos grasos libres) que integran la denominada: envoltura lipídica, que a su vez constituye el patrón que siguen los lípidos para la formación de la matriz lipídica extracelular de comportamiento líquido cristalino identificada como el “cemento” del modelo de mosaico fluido del EC. Esta doble envoltura corneocítica es el principal impedimento para la difusión vía transcelular, y por ende, la difusión pasiva de la mayoría de los xenobióticos ocurre por la ruta lipídica intercelular (Kalinin et al., 2001; Fireman et al., 2011; Sinkó et al., 2012; Van Smeden et al., 2014; Sahle et al., 2015).
Una característica importante de la matriz lipídica intercelular es su comportamiento físico variable; permutando en función de la temperatura y de la profundidad de la epidermis desde mesofases fluidas lamelares, cúbicas, ortorrómbicas y hexagonales, a una fase gel. Esta matriz lipídica en el EC contiene como principales componentes: alrededor del 40-50% de ceramidas, 20-35% de ácidos grasos libres (predominantemente de cadena larga y saturados), y 7-15% de colesterol, lo cual hace también que su comportamiento sea diferente al de otras membranas biológicas; exhibiendo distintas funciones de señalización esenciales para la proliferación y apoptosis celular. Deficiencias en cualquiera de las tres especies lipídicas resultan en anormalidades cutáneas caracterizadas por el incremento en la pérdida de agua transepitelial (Kalinin et al., 2001; Moser et al., 2001; Bouwstra y Ponec, 2006 Fireman et al., 2011; Menon et al., 2012; Sinkó et al., 2012; Van Smeden et al., 2014; Sahle et al., 2015).
La matriz lipídica intercelular tiene un arreglo de bicapas laminares con un empaquetamiento de dimensiones variables (longitud, proyección o profundidad y organización lateral), dependiendo esto último entre otros factores de la composición y longitud de cadena hidrocarbonada de los lípidos anfifílicos constituyentes (Figura 2). En el hombre, las bicapas intercelulares se presentan con un orden y distancia de repetición largo (~13 nm) o corto (~6 nm), mostrando asimismo tres tipos de organización lipídica lateral, donde las moléculas anfifílicas se observan en un plano perpendicular a la dirección de la organización de bicapas laminares. De tal forma, en el EC y los demás estratos de la epidermis viable, los lípidos intercelulares se organizan en una estructura ortorrómbica muy densa y ordenada o en un arreglo hexagonal menos denso y de organización intermedia, o bien en un estado líquido más desorganizado (Caussin et al., 2008).
Figura 2 Esquema de la matriz lipídica intercelular con su arreglo de bicapas laminares y empaquetamiento de dimensiones variables, mostrando asimismo tres tipos de organización lipídica lateral: ortorrómbica, hexagonal y líquida.
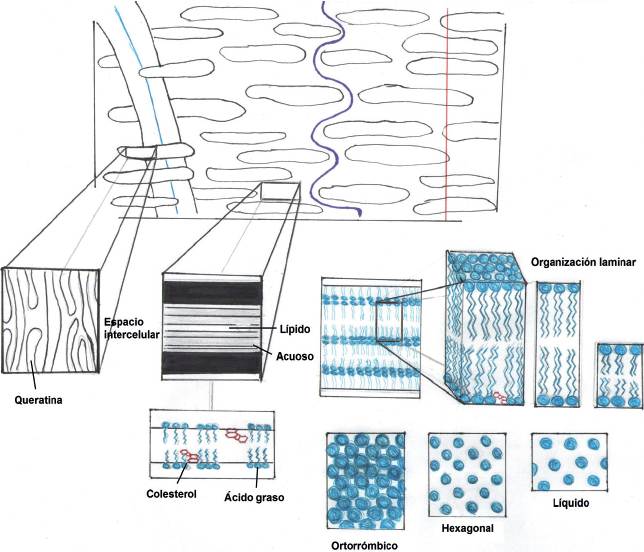
Debido a la mayor densidad del empaquetamiento lateral ortorrómbico de los lípidos intercelulares, sería de esperar que si esta organización prevalece en cualquiera de los estratos de la epidermis, esta estructura mesofásica sería la principal responsable de una verdadera función de barrera en la piel, no obstante, hasta el conocimiento actual aún existen incógnitas por despejar: 1) no es muy claro si a nivel de toda la epidermis coexisten junto con la mesofase ortorrómbica, la mesofase hexagonal y el estado líquido; 2) el tipo de empaquetamiento lateral de la matriz lipídica también es función de la profundidad del EC y la temperatura corporal. Así, ocurren transiciones desde la fase ortorrómbica a una hexagonal entre 30 y 40 °C. Por otro lado, el posterior aumento en la temperatura provoca una transición desde la fase hexagonal hacia una fase lamelar, desapareciendo en un intervalo de temperatura entre 60 y 75 °C con la formación de una fase líquida (Bouwstra y Ponec, 2006; Caussin et al., 2008). Estos últimos datos harían esperar que el empaquetamiento lateral ortorrómbico debiera ser la fase principal en las capas externas más frías del EC y que la organización hexagonal fuera la prevaleciente en las capas más internas del EC, donde la temperatura se aproxima a 37 °C, pero éste no es el caso; la fase hexagonal predomina en las capas superficiales del EC, desde valores de temperatura ambiente a 32 °C. Lo anterior tiene su explicación por la presencia en las capas superiores del EC, de los lípidos provenientes de las glándulas sebáceas que difunden parcialmente en la matriz intercelular formando arreglos hexagonales o generan transiciones de fase de ortorrómbicas a hexagonales (Bouwstra y Ponec, 2006).
Por otra parte, se reconoce la existencia de diferentes mecanismos que permiten y mejoran la penetración de los fármacos a través del EC, la mayoría relacionados con distintos tipos de interacción con la matriz de lípidos intercelulares. Propiedades como un pequeño tamaño de partícula y la posibilidad de incorporar promotores de la permeación en el sistema, que pueden difundir a la superficie de la piel e incrementar la permeación del fármaco, ya sea por medio del desordenamiento de la estructura lipídica del EC (facilitando la difusión a través de la barrera de la piel) o bien, por medio del incremento en la solubilidad del fármaco en la piel (aumento del coeficiente de partición del fármaco entre la piel y el vehículo), son algunas de las ventajas que proporcionan para la liberación de fármacos, sistemas con moléculas lipofílicas e hidrofílicas (aceite/agua y viceversa), que adoptan una estructura de dos o más fases en dispersión, como es el caso de las micro y nanoemulsiones, así como los cristales líquidos liotrópicos, lo cual conllevará al aumento en la dosis en contacto con la piel (Lopes, 2014).
Al utilizar sistemas dispersos aceite-agua de escala nanométrica, se acrecienta la penetración de fármacos en la piel por medio de una combinación de varias de sus propiedades y mecanismos de interacción con su entorno; su pequeño tamaño proporciona una superficie aumentada, favoreciendo un incremento en la relación área superficial/volumen; aunque no todos estos tipos de sistemas son igualmente efectivos (Lopes, 2014).
Cristales líquidos liotrópicos
A pesar de que la existencia y medios de elaboración de los cristales líquidos (CL) es conocida desde fines del siglo XIX, se advierte que aún en esta segunda década del siglo XIX su comprensión y la difusión de su uso son limitados. Sin embargo, a los CL se les encuentra en una diversidad de objetos de uso extendido y cotidiano, como las pantallas de calculadoras, relojes, juegos electrónicos, computadoras personales, televisores; en las ventanas que cambian de traslúcidas a opacas, en proyectores y fotocopiadoras; en los indicadores de temperatura y en los tejidos resistentes al fuego o a los impactos, así como en cosméticos como los champús. En medicina, destaca su empleo desde los años 90 del siglo XX en formulaciones para la aplicación tópica bucal de algunos antimicrobianos; pero ha sido hasta los inicios del siglo XXI- que estos sistemas mesofásicos han llamado la atención como sistemas de dosificación de fármacos debido a su considerable capacidad para solubilizar tanto fármacos liposolubles como hidrosolubles (Kalinin et al., 2001; Pasquali et al., 2006), así como por su similitud con las estructuras y composición de la membrana celular y de los fluidos intercelulares del sistema tegumentario (Pasquali et al., 2006; Patel et al., 2010; Hitesh et al., 2011; Chen y Gui, 2014).
Para conocer los materiales y comprender los mecanismos que dan lugar a la formación de los cristales líquidos es necesario recordar que los estados fundamentales de agregación molecular de la materia son: sólido, líquido y gas, y que para pasar de un estado a otro, se requiere de incrementos de energía cinética definidos por la temperatura a una presión atmosférica constante.
Por efecto de la temperatura, la mayoría de los sólidos funde generando líquidos de forma directa: no obstante, no todos se comportan de esta forma; existiendo casos en los que se observa un estado intermedio entre las fases sólidas y líquidas, llamado mesofase cristal líquido o líquido-cristalino (CL). Esta mesofase ocurre porque las sustancias adquieren propiedades intermedias de ambas fases. A nivel molecular (no observable a simple vista ni con microscopios ópticos) las sustancias que integran una mesofase CL poseen una estructura ordenada, pero al mismo tiempo, a nivel macromolecular muestran la movilidad (flujo) propia de un líquido. Los compuestos que tienen esta característica se denominan mesógenos y sus moléculas suelen tener una geometría determinada; siendo típicamente moléculas grandes y alargadas (como las de carácter anfifílico: tensioactivos, por ejemplo) o bien, discóticas; lo que facilita su colocación paralela y al mismo tiempo les otorga libertad de desplazamiento las unas respecto a las otras a lo largo de sus ejes (Figura 3).
Figura 3 Clasificación de los cristales líquidos: termotrópicos y liotrópicos. Ejemplos de moléculas que pueden formarlos.

El comportamiento de una sustancia como CL fue descrito por primera vez en 1888 por el botánico austriaco Friedrich Reinitzer, pero fue en 1889 que el físico alemán Otto Lehmann descubrió su estructura u orden molecular cristalino, denominándola “cristal líquido”. Se puede decir que la existencia de los CL ocurre por un fenómeno supramolecular basado en interacciones débiles no covalentes del tipo dipolo-dipolo o fuerzas de dispersión entre moléculas y para que éstas sean suficientemente importantes, generalmente es necesario que las moléculas tengan anisotropía (propiedades dependientes de la orientación con respecto al material, en la que se hace la medición) y que las fuerzas de unión no impidan su libertad de movimiento (Müller-Goymann, 2002; Pasquali et al., 2006; Patel et al., 2010; Tadwee et al., 2012).
Los CL se clasifican de acuerdo con su composición en dos grandes grupos (Figura 3): termotrópicos y liotrópicos; los CL termotrópicos (del griego thérme, calor, y tropé, cambio) se forman por el calentamiento de ciertos sólidos a una temperatura característica para cada sustancia. La temperatura genera una desestructuración en la cual desaparece el orden a nivel molecular y el sistema presenta las características de un líquido ordinario. A esta categoría pertenece el primer CL identificado como tal por Lehmann: el benzoato de colesterilo, cuya transición ocurre entre 145.5 y 178.5 °C (Pasquali et al., 2006 ). Por otra parte, los CL liotrópicos (CLL) se forman cuando algunas sustancias, particularmente de estructura anfifílica, se dispersan en un líquido a una determinada concentración (5, 10, 15 o 20% p/p) y cierto intervalo de temperatura (20 y 80 °C), así como en condiciones energéticas favorables (agitación mecánica, ultrasonicación, entre otras). El nombre deriva del latín lyo, que significa desleír o disolver. Es así que en los CLL los mesógenos no son las moléculas en sí mismas, sino sus hidratos o solvatos. Por otro lado, con los CLL, sucede igual como con los termotrópicos (CLT), una variación en la temperatura también puede causar una transición de fase entre diferentes mesofases (Müller-Goymann, 2002; Pasquali et al., 2006; Patel et al., 2010; Tadwee et al., 2012; Chen y Gui, 2014; Kim et al., 2015).
Los sistemas CLL más comunes están constituidos por dispersiones de tensioactivos en agua. También pueden formar parte de estas mesofases liotrópicas otras sustancias anfifílicas como los ácidos grasos y esteroles, además de aminas y alcoholes de cadena larga. Debido a que la mayor parte de los CLL están formados por dispersiones acuosas de tensoactivos en agua, su formación estará condicionada también a sobrepasar la concentración micelar crítica (CMC), valor de concentración a partir del cual el tensio-activo forma asociaciones moleculares denominadas micelas; dependiendo su forma de agrupación o estructura, de la naturaleza del sistema y de la temperatura (Figura 4); siendo las principales: la laminar (Lα ), la hexagonal normal (H1), la hexagonal inversa (H2) y la cúbica (identificada como Q o V, según el autor).
Figura 4 Autoensamblaje de las moléculas anfifílicas para formar las estructuras micelares supramoleculares, unidades básicas de las mesofases lamelar, cúbica y hexagonal normal e inversa.
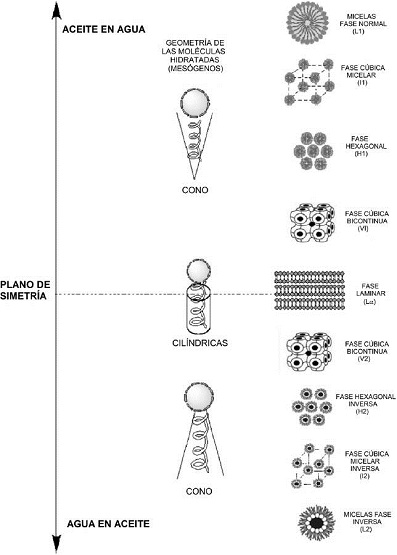
De lo anterior se deduce que una característica importante de los CLL es el autoensamblaje de las moléculas anfifílicas como estructuras micelares supramoleculares, las cuales son las unidades básicas de la mesofase. El grado de hidratación o solvatación dependerá de las propiedades anfifílicas de la molécula. La hidratación y solvatación de la mayoría de las moléculas tipo varilla resulta en diferentes figuras geométricas tales como conos o cilindros (Figura 4). Los cilindros se acomodan en láminas; lo que resulta en fases laminares que alternan capas polares y no polares.
Un incremento en la concentración de disolvente transforma la molécula en forma de varilla solvatada en una forma cónica, conduciendo a un cambio de fase. Dependiendo del carácter polar o no polar del agente solvatador y de la molécula misma, la transición resulta en una fase hexagonal o hexagonal inversa. En la fase hexagonal, la cantidad de agua o disolvente no polar que puede añadirse es limitada. Conforme la geometría molecular sigue cambiando durante la solvatación, otra transformación de fase hacia la forma cúbica (tipo I) o cúbica inversa (tipo IV) ocurre, la cual consiste en micelas esféricas o elipsoidales y en micelas inversas o ambas.
Las fases liotrópicas que se presentan con mayor frecuencia en las formulaciones farmacéuticas y cosméticas son la laminar, la hexagonal normal e inversa y la cúbica. La viscosidad de estos sistemas suele ser alta, siendo esta propiedad y su capacidad para disolver tanto fármacos hidrosolubles como liposolubles, lo que hace que los CLL resulten potencialmente adecuados como sistemas de liberación controlada de principios activos; alojándose los fármacos liposolubles entre las cadenas hidrocarbonadas y los fármacos hidrosolubles en la zona polar.
El sistema más estudiado con este fin es el formado por monooleato de glicerilo (monooleína) y agua. Este sistema a la temperatura del cuerpo humano presenta la fase laminar, pero a mayor dilución, se torna en una fase cúbica bicontinua (Pasquali et al., 2006). La formación de geles cúbicos in situ se ha utilizado para la liberación sostenida periodontal de antibióticos, inyectándose en el saco periodontal monooleato de glicerilo conteniendo un antibiótico en fase laminar, donde este sistema absorbe agua y se transforma en una fase cúbica de mayor viscosidad, que libera el fármaco lentamente (Norling et al., 1992; Shah et al., 2001).
Las fases muy viscosas se hacen difíciles de manejar, limitando su aplicación y lo que es más, pueden causar irritación cuando se ponen en contacto con el epitelio biológico; por lo que para superar lo anterior, una estrategia innovadora ha sido dispersar la fase original en agua en la forma de pequeñas partículas (Yaghmur, y Glatter, 2009; Guo et al., 2010; Lodha et al., 2014); pero una característica de gran relevancia es asegurar que el sistema mesofásico inicial de interés, ya sea hexagonal o cúbico, por ejemplo, mantenga su estructura intacta al diluirse (dispersarse) en el medio acuoso (Amar-Yuli et al., 2007).
Cuando los CLL cúbicos o hexagonales se dispersan en un exceso de agua y a esta mezcla se adiciona agentes estabilizantes (tales como copolímeros de polioxietileno/polioxipropileno: Poloxámero o Pluronic®), forman dispersiones coloidales que son conocidas como cubosomas y hexosomas, respectivamente. En general, los métodos de preparación de CLL cúbicos y hexagonales son más sencillos que los de sus dispersiones. Por ejemplo, CLL cúbicos o hexagonales pueden ser preparados al mezclar fases lipídicas anfifílicas y acuosas con un vortex. En contraste, la fabricación de cubosomas o hexosomas implica un acertado juego de concentraciones de componentes, incluyendo al agente estabilizante, así como un manejo adecuado de la temperatura y el suministro de energía de alto nivel al sistema. Las técnicas que se emplean para su obtención coinciden con lo aplicado en lo general en la nanotecnología: 1) miniaturización (top-down), y, 2) amplificación (bottom-up); en la primera generalmente se hidrata la mezcla de lípidos que forman la estructura y los estabilizantes para permitir el autoensamblado en un material viscoso; para posteriormente dispersar el material con alta energía en una solución acuosa, utilizando homogenización a alta presión y/o ultrasonicación; con la segunda técnica de preparación el factor clave es la presencia de un hidrótropo, el cual puede disolver lípidos insolubles en agua para crear un precursor líquido y prevenir la formación de CLL a concentraciones elevadas. La adición controlada de medio acuoso en la solución anterior reduce rápidamente la solubilidad del lípido, resultando entonces en la formación de cubosomas o hexosomas. El método requiere baja energía y tiene la ventaja de producir nanopartículas de tamaño reducido, así como buena estabilidad (Amar-Yuli et al., 2007; Guo et al., 2010; Chen y Gui, 2014; Lodha et al., 2014).
En los estudios sobre liberación in vitro de fármacos tanto hidrofílicos como lipofílicos contenidos en mesofases líquido cristalinas liotrópicas con alta viscosidad o sistemas dispersos más fluidos (cubosomas o hexosomas), se ha mostrado que la liberación del activo sigue el modelo cinético controlado por difusión de Higuchi, es decir, la cantidad acumulada de fármaco liberado se debe a la difusión de éste a través de la matriz líquido cristalina y presenta una dependencia lineal con la raíz cuadrada del tiempo. No obstante lo anterior, se han desarrollado también sistemas farmacéuticos nanoparticulados basados en dispersiones acuosas de cristales líquidos liotrópicos hexosómicos cargados con distintos principios activos, que han mostrado un flujo tipo newtoniano y un comportamiento de liberación de los activos que sigue una cinética de primer orden, es decir, la cantidad de fármaco liberada es proporcional a la cantidad de activo que permanece en el interior del sistema líquido cristalino hexosómico (Gazga-Urioste, 2014; Quirino-Barreda et al., 2015).
Propiedades de los cubosomas y hexosomas que les confieren potencial uso tópico terapéutico
Los CLL han sido considerados como sistemas innovadores para la liberación de fármacos debido a sus propiedades físicoquímicas únicas, teniendo como ventajas (Shah et al., 2001; Müller-Goymann, 2002; Amar-Yuli et al., 2007; Yaghmur y Glatter, 2009; Guo et al., 2010; Tadwee et al., 2012; Chen y Gui, 2014; Kim et al., 2015):
a) La solubilización efectiva del principio activo que, comparada con otros acarreadores tradicionales, es alta; además, exhiben gran flexibilidad en términos de composición. b) Una elevada capacidad de carga para fármacos con un amplio rango de polaridades y tamaños moleculares; presentando una biodisponibilidad de 20 a >100 veces mayor para péptidos solubles en agua. c) Una gran capacidad de protección de fármacos sensibles a degradación física, química y enzimática, siendo, por otra parte, mesofases que por estar compuestas en su mayoría de lípidos no tóxicos, biodegradables y fisicoquímicamente estables, pueden utilizarse para varias vías de administración. d) Una composición y estructura mesofásica que pueden ser diseñadas para proporcionar un comportamiento físico y fisicoquímico manipulable para regular la liberación lenta y sostenida de moléculas pequeñas como los fármacos tradicionales obtenidos por síntesis química o bien, de péptidos, proteínas y ácidos nucléicos, entre otras biomoléculas.
En el caso particular de los sistemas dispersos líquido cristalinos liotrópicos cubosómicos (cubosomas) y hexosómicos (hexosomas), su gran potencial de uso tópico medicinal radica en varias propiedades como las que se resumen a continuación:
1. Fluidez, extensibilidad superficial y afinidad con las capas más superficiales de la piel. Las dispersiones líquido cristalinas hexosómicas así como las cubosómicas, comparadas con sus respectivas mesofases viscosas cúbicas y hexagonales, muestran buena fluidez y gran dispersibilidad o extensibilidad superficial, proporcionando un contacto más íntimo con la piel; además, estas composiciones pueden ser integradas en otras formulaciones (cremas o pomadas, por ejemplo) y no causan irritación después de la aplicación tópica (Guo et al., 2010; Lodha et al., 2014; Quirino--Barreda et al., 2015). 2. Composición lipídica anfifílica que favorece inclusión de fármacos polares y apolares, así como interacción-difusión con lípidos de la piel. La composición a base de lípidos anfifílicos como sería el caso del monooleato de glicerilo favorece la inclusión de fármacos altamente lipófilos, así como de moléculas hidrófilas. Este tipo de lípidos posee también una gran afinidad con los lípidos intercelulares del estrato córneo, posibilitando la disrupción del ordenamiento estructural de las cadenas hidrocarbonadas de las bicapas y con ello un incremento en la fluidización de las mismas, lo que facilita la penetración de fármacos lipofílicos. Estos cambios influyen asimismo en el orden de las porciones polares, lo cual explica el incremento de la penetración de fármacos hidrofílicos (Trommer y Neubert, 2006). 3. Tamaño nanométrico, composición y organización estructural que favorecen permanencia de la composición en la piel, así como el control de la liberación del fármaco. El tamaño submicrónico y la organización que adoptan las moléculas anfifílicas de estos sistemas dispersos nanoestructurados, teniendo similitud sus mesofases cúbicas y hexagonales, respectivamente, con las estructuras mesofásicas cúbica y hexagonal-ortorrómbica, de los corneocitos y de los lípidos que los rodean; hacen razonable suponer una interacción entre el sistema líquido cristalino y las capas de la piel; conduciendo a la formación de un depósito del sistema en la piel a partir del cual el fármaco sea liberado de manera controlada (Patel et al., 2010; Chen y Gui, 2014; Norlén y Al-Amoudi, 2004). Es así que en los últimos años del presente siglo XXI, se observa un paulatino incremento en publicaciones y patentes sobre medicamentos a base de cristales líquidos, de modo que el enorme potencial que tienen estos sistemas para la terapéutica está evolucionando más allá de conseguir transiciones de sistemas líquidos a gel por efecto de la temperatura en el sitio de aplicación, como es el caso de los iniciales sistemas tipo depósito desarrollados en los años 90 del siglo XX, mediante los cuales se dosificaban por vía tópica bucal antimicrobianos como el Metronidazol para el tratamiento de gingivitis y periodontitis (Norling et al., 1992; Shah et al., 2001); sino que en la actualidad se persigue llegar, mediante un diseño de producto basado en conocimientos de farmacia molecular y fisicoquímica farmacéutica, a una composición y proceso de elaboración, a productos tópicos de base líquido cristalina que a partir de una mesofase inicial previamente determinada (cubosómica, ortorrómbica u hexagonal), éstos difundan y se depositen en la capa de la piel (epidermis o dermis) donde se requiera la actividad; en este proceso la temperatura corporal también tendrá su desempeño en la realización de transiciones reversibles de fase, consiguiéndose así una acción de depósito y de control de la liberación del fármaco.
Un ejemplo de lo anterior es el sistema farmacéutico nanoparticulado basado en dispersiones acuosas de cristales líquidos liotrópicos hexosómicos como el mostrado por la Figura 5 y Tabla 1 (Quirino-Barreda et al., 2015; Gazga-Urioste, 2015). La Figura 5 muestra el aspecto macroscópico líquido y opalescente del sistema y en el recuadro se observa la morfología hexagonal que adopta el conjunto de moléculas que lo constituyen, vistas con la ayuda de un microscopio electrónico de transmisión y una técnica de tinción negativa del sistema nanoestructurado. Por otra parte, en la Tabla 1 se muestran los resultados de tamaño de partícula y morfología de hexosomas obtenidos con fármacos de distinto tamaño molecular y propiedades fisicoquímicas como solubilidad y coeficiente de reparto (log P).
Figura 5 Aspecto macroscópico de sistema farmacéutico nanoparticulado basado en dispersiones acuosas de cristales líquidos liotrópicos. El recuadro muestra la organización interna supramolecular hexosómica observada por microscopía electrónica de transmisión (MET) con tinción negativa.

Tabla 1 Morfología y tamaño de partícula promedio de hexosomas elaborados sin y con fármacos de distinto tamaño molecular y propiedades fisicoquímicas como el coeficiente de reparto (log P).
Formulación
Principio
Tamaño de
Log P
Imagen (MET)
1
Placebo
86.56
-
![]()
2
Ketoconazol
85.93
4.3
![]()
3
Estearato
de
83.04
2.7/3.06
![]()
4
Trimetoprim
83.69
0.91
![]()
5
Sulfametoxazol
86.03
0.9
![]()
6
Metronidazol
85.31
0
![]()
En resultados de estudios de calorimetría realizados con hexosomas conteniendo el antimicótico Ketoconazol (Gazga-Urioste, 2015), se obtuvo que éstos exhiben propiedades biomiméticas de transición de fase reversible en el intervalo de la temperatura corporal, como sucede con los lípidos intercelulares de la piel. Además, considerando que para fármacos como el Ketoconazol se busca un efectivo tratamiento antimicótico tópico local mediante la retención y liberación prolongada de la dosis en el estrato córneo y las subsecuentes capas de la epidermis, los resultados obtenidos con este tipo de sistema nanoestructurado líquido cristalino hexosómico mostraron, entre otros datos de interés para una efectiva terapia tópica local, lo siguiente:
1) Que el Ketoconazol se libera lentamente (alrededor del 86% en 24 h) y con una cinética de primer orden (la cantidad de activo liberada es proporcional a la cantidad de fármaco que permanece en el interior del hexosoma). 2) Que en ensayos in vitro con membranas de piel de oreja de cerdo, más del 97% de Ketoconazol contenido en el CLL queda retenido en la piel y que en comparación con otras formulaciones comerciales tópicas que contienen Ketoconazol, la concentración mínima inhibitoria (CMI) contra Candida albicans es mucho menor al utilizar los sistemas líquido cristalinos; siendo la cmi de 40 µg/mL para las formulaciones comerciales, mientras que con los CLL hexosómicos ésta fue de 24 µg/mL (Santiago-Téllez, 2014).
Reflexión final
Sobre toda la información antes expuesta, se puede concluir que en el avance en el conocimiento de la composición y estructura de la piel, y de manera particular de las propiedades mesofásicas de los lípidos intercelulares que controlan la difusión de las moléculas a través de la epidermis, se están logrando importantes desarrollos nanotecnológicos en medicamentos de uso tópico bioinspirados en ellos, como es el caso de las dispersiones nanométricas de cristales líquidos liotrópicos que han demostrado un comportamiento térmico biomimético al de los lípidos intercelulares de la piel, así como una permeación y retención epidérmica que les otorga gran potencial como nanomedicamentos para uso tópico.
Bibliografía
- Amar-Yuli, I., Wachtel, E., Ben Shoshan., E., Danino, D., Aserin, A. y Garti, N. (2007). Hexosome and hexagonal phases mediated by hydration and polymeric stabilizer. Langmuir, 23: 3637-3645.
- Bouwstra, J.A. y Ponec, M. (2006). The skin barrier in healthy and diseased state. Biochimica et Biophysics, 1758: 2080-2095.
- Caussin, J., Gooris, G.S., Bouwstra, J.A. (2008). FTIR studies show lipophilic moisturizers to interact with stratum corneum lipids, rendering the more densely packed. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1778 (6): 1517-1524.
- Chen, Y., Ma, P., Gui, S. (2014). Cubic and hexagonal liquid crystals as drug delivery systems. BioMed Research International, 1-12.
- Faustino-Vega, A. y Quirino-Barreda, C. T. (2014). Nanomedicina y biomimetismo. MundoNano, 7 (12): 19-31.
- Fireman, S., Toledano, O., Neimann, K., Loboda, N. y Nava, D. (2011). A look at emerging delivery systems for topical drug products. Dermatologic Therapy, 24 (5): 477-488.
- Gazga-Urioste, C. (2015). Evaluación de las propiedades fisicoquímicas y de la cinética de difusión percutánea in vitro, de cristales líquidos liotrópicos cargados con Ketoconazol. Tesis de maestría en ciencias farmacéuticas. UAM-X. México. pp. 107-109.
- Guo, C., Wang, J., Cao, F., Lee, R., Zhai, G. (2010). Lyotropic liquid crystal systems in drug delivery. Drug Discovery Today. 15(23/24): 1032-1040.
- Herman, S. (2010). Liquid crystals and the skin. Chemical Reaction. Global Cosmetic Industry, 178 (2): 54-55.
- Hitesh, J., Rushikesh, G., Gauri, J., Jagruti, M., Nirali, T. (2011). Liquid crystal as accelerant in drug absorption from topical formulations. International Research Journal of Pharmacy, 2(4): 86-89.
- Kalinin, A., Marekov, L., Steinert, P. (2001). Assembly of the epidermal cornified cell envelope. Journal of Cell Science, 114 (17): 3069-3070.
- Kilian, D., Shahzad, Y., Fox, L., Gerber, M., Du Plessis, J. (2015). Vesicular carriers for skin drug deliver: The Pheroid™ technology. Current Pharmaceutical Design, 21(20): 2758-2770.
- Kim, D-H., Jahn, A., Cho, S-J., Kim, J., Ki, M-H., Kim, D-D. (2015). Lyotropic liquid crystal systems in drug delivery: A review. Journal of Pharmaceutical Investigation, 45: 1-11.
- Lodha, A., Jadhav, G., Pande, V. (2014). Liquid crystals as a cubo-hexagonal topical controlled drug delivery system. Pharmacophore, 5(3): 430-441.
- Lopes, L.B. (2014). Overcoming the cutaneous barrier with microemulsions. Pharmaceutics, 6 (1): 52-77.
- Magaña G., M., Magaña L., M. (2003). Dermatología. México: Editorial Panamericana. pp 1-17, 115-140.
- Menon, G., Cleary, G., Lane, M. (2012). The structure and funtion of the stratum corneum. International Journal of Pharmaceutics, 435: 3-9.
- Moser, K., Kriwet, K., Naik, A., Kalia, Y., Guy, R. (2001). Passive skin penetration enhancement and its quantification in vitro. European Journal of Pharmaceutical Biopharmaceutics, 52: 103-112.
- Mugglestone, C.J., Mariz, S., Lane, M. E. (2012). The development and registration of topical pharmaceuticals. International Journal of Pharmaceutics, 435: 22-26.
- Müller-Goymann, C. (2002). Drug delivery-liquid crystals. En: Encyclopedia of Pharmaceutical Technology. Editorial Marcel Dekker, Inc. 2a ed. USA, pp. 834-851.
- Müller-Goymann, C.C. (2004). Physicochemical characterization of colloidal drug delivery systems such as reverse micelles, vesicles, liquid crystals and nanoparticles for topical administration. European Journal of Pharmaceutics and Biopharmaceutics, 58 (2): 343-356.
- Norlén, L. y Al-Amoudi, A. (2004). Stratum corneum keratin structure, function, and formation: The cubic rod-packing and membrane templating model. The investigative Dermatology, 123: 715-732.
- Norling, T., Lading, P., Engström, S., Larsson, K., Krog, N. y Nissen, S. S. (1992). Formulation of a drug delivery system based on a mixture of monoglycerides and tryglicerides for use in the treatment of periodontal disease. Journal of Clinical Periodontology, 19 (9): 687-692.
- Pasquali, R., Bregni, C., Serrano, R. (2006). Características e identificación de los cristales líquidos liotrópicos. Revista Mexicana de Ciencias Farmacéuticas, 37(2): 38-53.
- Patel, P., Patel, J., Dangar, R., Patel, K., Chauhan, K. (2010). Liquid crystal drug delivery system. International Journal of Pharmaceutical and Applied Sciences, 1 (1): 118-123.
- Quirino-Barreda, C.T., Noguez-Méndez, N.A., Rivera-Becerril, E., Gazga-Urioste, C., Pérez-Hernández, G., Maldonado-Campos, J.F.J., Palma-Ramos, A., Castrilón- Rivera, L.E., Juárez-Sandoval, J.J., Santiago-Téllez, A., Faustino-Vega, A., Gutiérrez-Zamora, A.C., Macín-Cabrera, S.A., Rubio-Martínez, A., Ramírez- Palma, J.A. y Campos-Terán, J. (2015). Composición tópica con base en cristales líquidos liotrópicos. IMPI. No. Expediente: MX/a/2015/009845; Folio: MX/E/2015/054803. De fecha 30 de julio, 2015. México.
- Sahle, F.F., Gebre-Mariam, T., Dobner, B., Wohlrab, J. y Neubert, R.H.H. (2015). Skin diseases associated with the depletion of stratum corneum lipids and stratum corneum lipid substitution therapy. Skin Pharmacology and Physiology, 28: 42-55.
- Santiago-Téllez, A. (2014). Determinación del efecto antimicótico de Ketoconazol incorporado en cristales líquidos liotrópicos en C. albicans. Tesis de maestría en ciencias farmacéuticas. UAM-X. México. pp. 97-101.
- Shah, J. C., Sadhale, Y. y Chilukuri, D.M. (2001). Cubic phase gels as drug delivery systems. Advanced Drug Delivery Reviews. 47 (2-3): 229-250.
- Sinkó, B; Garrigues, T; Balogh, G; Nagy, Z; Tsinman, O; Avdeef, A; Takács-Novák, K. (2012). Skin-pampa: A new method for fast prediction of skin penetration. European Journal of Pharmaceutical Sciences, 45: 698-707.
- Tadwee, I: Shahi, S; Ramteke, V; Syed, I. (2012). Liquid crystals pharmaceutical application: A review. International Journal of Pharmaceutical Research and Allied Sciences, 1(2): 06-11.
- Trommer, H. y Neubert, R. (2006). Overcoming the stratum corneum: The modulation of skin penetration. A review. Skin Pharmacology and Physiology, 19: 106- 121.
- Van Smeden, J., Janssens, M., Gooris, G. S., Bouwstra, J. A. (2014). The important role of stratum corneum lipids for the cutaneous barrier function. Biochimica et Biophysica Acta, 1841: 295-313.
- Vélez, H; Rojas, W; Borrero, J; Restrepo, J. (2009). Fundamentos de medicina. Dermatología. 7a ed. Colombia: Editorial Corporación para investigaciones biológicas. pp 3-38, 72-77, 185-191.
- Weiss, S.C. (2011). Conventional topical delivery systems. Dermatologic Therapy, 24 (5): 471-476.
- Yaghmur, A; Glatter, O. (2009). Characterization and potential applications of nanostructured aqueous dispersions. Advances in Colloid and Interface Science, 147-148: 333-342.
- Zhang, W. y Liu, L. (2013). Study on the formation and properties of liquid crystal emulsion in cosmetic. Journal of Cosmetics, Dermatological Sciences and Applications, 3: 139-144.