www.mundonano.unam.mx | Mundo Nano
http://dx.doi.org/10.22201/ceiich.24485691e.2017.19.61783 | 10(19), 72-92, julio–diciembre 2017
Artículos
Las nanopartículas bimetálicas y algunas de sus aplicaciones*
Antonio Aguilar–Tapia**
Rodolfo Zanella**
** Centro de Ciencias Aplicadas y Desarrollo Tecnológico-Universidad Nacional Autónoma de México, Circuito Exterior S/N, Ciudad Universitaria, A. P. 70-186, Delegación Coyoacán, C.P. 04510, Cd. Mx. México. Correspondencia: (aguilar.iq@gmail.com), (rodolfo.zanella@ccadet.unam.mx) tel. +52 (55) 56228601.
Resumen:
En las últimas décadas ha habido un enorme interés por el estudio de las nanopartículas bimetálicas debido a su potencial en distintos campos de aplicación, ya que normalmente presentan propiedades mejoradas respecto a las de los componentes individuales por separado. El control efectivo del tamaño, forma, arquitectura y composición de los metales en las partículas juegan un papel muy importante en la mejora de sus características, de las cuales dependen sus múltiples aplicaciones, desde la catálisis (posiblemente el área en que más se han estudiado y aplicado las partículas bimetálicas) hasta su uso como biosensores o en aplicaciones biomédicas.
Palabras clave: Nanomateriales, partículas bimetálicas, aplicaciones.
Abstract:
The study of bimetallic nanoparticles has been of great interest in the last decades because of their promising potential in different application areas because they exhibit improved features in comparison with their monometallic counterparts. The adequate control of the size, shape, architecture and metal composition plays an important role in the improvement of their characteristics on which depend their multiple applications, since catalysis science (probably the most studied field for bimetallic catalysts) to their use as biosensors or biomedical applications.
Keywords: Nanomaterials, bimetallic nanoparticles, applications.
Recibido: 30 de mayo de 2017.
Aceptado: 30 de agosto de 2017.
Introducción
Los materiales metálicos tienen un papel muy importante en nuestra vida cotidiana. Desde la arquitectura, transporte, tecnología electrónica, ciencia de la información y tecnología hasta aplicaciones biomédicas. Comparados con sus contrapartes másicas, los cuales poseen un alto esfuerzo mecánico, buena maleabilidad y propiedades electromagnéticas, los nanomateriales (<100 nm) muestran propiedades físicas y químicas peculiares, debido al efecto de tamaño, área superficial y efectos cuánticos.
En comparación con las nanopartículas monometálicas, los materiales bimetálicos son muy importantes debido a sus múltiples ventajas (Somorjai et al., 2008; Renzas et al., 2011; Alayoglu et al., 2011; Tao et al., 2008 y 2010; Toshima y Yonezawa 1998) pues la combinación de dos metales puede resultar en cambios importantes en sus propiedades (magnéticas, eléctricas u ópticas) en comparación con su comportamiento individual. Estos materiales usualmente presentan propiedades catalíticas (Toshima y Yonezawa, 1998; Scott et al., 2003), electrónicas (Harikumar et al., 1997), ópticas (Mallin y Murphy, 2002) y estructurales diferentes respecto de sus correspondientes contrapartes monometálicas, y tienen aplicaciones tecnológicas como catalizadores, sensores, dispositivos nanoelectrónicos, además de aplicaciones médicas y como biosensores, la aplicación y el desempeño de estas nanopartículas depende de su tamaño, forma, composición y estructura.
Nanopartículas bimetálicas
Actualmente las nanopartículas bimetálicas (compuestas por dos diferentes elementos metálicos) atraen más la atención que las monometálicas debido a sus propiedades electrónicas, magnéticas y ópticas, así como su desempeño en procesos catalíticos o fotocatalíticos (que pueden ser mejoradas respecto a sus contrapartes monometálicas), estos materiales tienen un cierto patrón de mezclado o secuencia química y arquitectura geométrica y tienen funciones específicas (Ge et al., 1998; Massicot et al., 2000; Nutt et al., 2006; Mu et al., 2011).
Al combinar dos metales en estos nanomateriales, su desempeño muchas veces supera las propiedades asociadas con sus contrapartes monometálicas, es decir, las propiedades fisicoquímicas de las partículas bimetálicas son mejores que las propiedades de las nanopartículas de los metales por separado, lo que se explica comúnmente como efectos sinérgicos (Ge et al., 1998; Massicot et al., 2000; Nutt et al., 2006; Mu et al., 2011) y cambiando sus componentes y morfologías se puede modificar exitosamente su desempeño físico, eléctrico o químico (Sobal et al., 2003; Kodama et al., 2006).
Comparados con los materiales monometálicos, las estructuras de los nanocristales bimetálicos son marcadamente más complicadas, su estructura depende de las propiedades termodinámicas del sistema (Ponec, 2001). En general, la estructura de los sistemas bimetálicos, donde A es un metal y B es el segundo metal, dependiendo de la miscibilidad de los metales, se encuentra definida por el modo de distribución que presentan los metales al formar las nanopartículas, dichas estructuras pueden ser:
a) Estructuras tipo núcleo-coraza (core-shell), en donde un núcleo monometálico A es cubierto con una coraza del metal B (Figura 1a). b) Cúmulos segregados de átomos A que comparten la interfase con cúmulos de átomos B (Figura 1b). c) Nanoaleaciones de dos tipos de átomos ya sea de manera ordenada o como soluciones sólidas (Figura 1c). d) Nanopartículas compuestas por multicapas o estructura tipo “cebolla” con capas alternadas (Figura 1d).
Figura 1 Representación esquemática de posibles formas de mezclado: a) estructura tipo núcleo-coraza, b) cúmulos segregados, c) aleación o solución sólida y, d) multicapas.
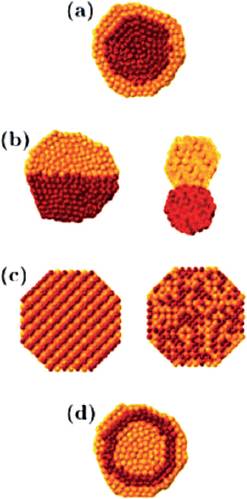
Fuente: Reproducida con permiso de Ferrando et. al., 2008. Copyright (2008) American Chemical Society.
Los materiales bimetálicos a escala nanométrica modifican sus propiedades principalmente por efectos geométricos y/o por efectos electrónicos. El efecto geométrico se refiere a un número finito de átomos de los dos metales en una orientación geométrica específica que se requiere para mejorar algún proceso, es decir, la existencia y distribución de dos tipos de átomos metálicos en la superficie de la nanopartícula bimetálica puede influir en la manera en que el material interactúa con su entorno. El efecto ligando o electrónico, en general, se refiere a la modificación de la distribución de la densidad electrónica como consecuencia de la formación de enlaces mezclados. De hecho, no se puede variar la composición de la superficie del material sin afectar tanto la estructura electrónica como la geométrica de los átomos individuales constituyentes en la superficie de la nanopartícula bimetálica. Aun así, se sugiere que el efecto geométrico, mencionado anteriormente, tenga un papel más dominante que el efecto ligando y estos efectos pueden actuar colectivamente.
Es muy importante entender el proceso de formación de las partículas bimetálicas para diseñar materiales con propiedades y aplicaciones específicas. Aunque se han desarrollado varios métodos para la preparación de materiales monometálicos (especialmente para Au, Ag, Pd, Pt, etc.) (Wang et al., 2008; Sau y A. L. Rogach, 2010), la síntesis controlada de materiales bimetálicos es un asunto más complicado (Banin, 2007; Rui et al., 2010). Los métodos en solución son mucho más versátiles en un sistema de síntesis en solución, los procesos de nucleación y crecimiento de los nanomateriales bimetálicos pueden ser fácilmente controlados ajustando los parámetros de reacción, como son la concentración de los reactantes, la relación molar entre los precursores y surfactantes y la temperatura y el tiempo de reacción. Sin embargo, en algunos casos no es fácil coordinar la nucleación y el crecimiento de los dos distintos metales debido a sus características termodinámicas y cinéticas diferentes bajo las mismas condiciones de reacción (Banadaki y Kajbafvala, 2014).
Caracterización de partículas bimetálicas
La forma en cómo se mezclan los dos metales es una de las características más importantes en las nanopartículas bimetálicas y esto influye directamente en las propiedades del material. Usualmente se utilizan combinaciones de diferentes técnicas para caracterizar los materiales, pues el estudio de sistemas en escala nanométrica requiere una alta precisión en la obtención de los parámetros geométricos y propiedades fisicoquímicas de los materiales. En la Tabla 1 se mencionan algunos de los métodos más utilizados en la caracterización de nanomateriales, así como la información que proporcionan para la caracterización de estos materiales.
Tabla 1 Técnicas de caracterización de nanopartículas y la información que proporcionan.
Técnica utilizada
Propiedad determinada
Microscopía electrónica de transmisión (TEM)
Tamaño y forma de partícula, cristalinidad en la superficie
Microscopía electrónica de barrido (SEM)
Tamaño de partícula, morfología superficial
Microscopía de fuerza atómica (AFM)
Tamaño de partícula, morfología superficial
Microscopía de efecto túnel (STM)
Tamaño de partícula, morfología superficial, conductividad
Difracción de rayos X en polvos (XRD)
Fases cristalinas y/o cristalinidad
Dispersión de rayos X a bajos ángulos (SAXS)
Composición de fases, análisis de la nanoestructura (forma, tamaño y estructura interna)
Espectroscopia fotoelectrónica de rayos X (XPS)
Energía de enlace de los electrones, estado de oxidación, composición química de la superficie
Espectroscopia de emisión de rayos X (XES)
Banda prohibida, estructura de bandas electrónicas, distribución de la densidad de estados de los electrones de valencia
Espectroscopia de absorción de rayos X (EXAFS)
Distancias, números de coordinación y especies de los vecinos del átomo absorbente
Espectroscopia de absorción de rayos X (XANES)
Estado de oxidación formal y la química de coordinación del átomo absorbente
Espectroscopia infrarroja de moléculas prueba adsorbidas (CO, por ejemplo)
Composición cuantitativa y cualitativa de los sitios de adsorción en la superficie
Reducción a temperatura programada (TPR)
Estado de oxidación y reducibilidad de las especies presentes en la muestra
Energía dispersiva de rayos X (EDX)
Análisis elemental de la superficie y del nanomaterial
Propiedades ópticas
Los metales nobles en su estado másico son conocidos por su alta conductividad térmica y eléctrica, propiedades mecánicas específicas y alta reflectividad de la radiación incidente. Estas propiedades son causadas por su estructura cristalina y la presencia de electrones deslocalizados. Disminuyendo el espesor de películas metálicas se pueden observar nuevas propiedades en los materiales. Las propiedades ópticas no son la excepción y es posible advertir un gran cambio en la apariencia de un material de la misma composición, pero diferente nanoestuctura. El oro, por ejemplo, en su estado másico es conocido como un metal brillante, amarillo y que no se mancha. Sin embargo, cuando el mismo material (oro) se encuentra en forma de nanopartículas puede ser transparente y cambiar su color a rojo dependiendo del tamaño de las nanopartículas (Figura 2). En el caso de las partículas bimetálicas, el color de la dispersión coloidal también depende de la forma y tamaño de las nanopartículas. Para estructuras tipo núcleo-coraza, el color que se observa depende principalmente del metal presente en la superficie y en aleaciones el color es dominado por el metal más abundante (Zaleska-Medynska et al., 2016).
Figura 2 Dependencia del tamaño de las propiedades de absorción óptica del coloide de oro.

Fuente: Adaptado con permiso de (Mayer y Hafner, 2011). Copyright (2011) American Chemical Society.
Un buen ejemplo del ajuste de las propiedades ópticas (y electrónicas) de un material al modificar su estructura son las nanopartículas de CdS. Controlando el tamaño de las nanopartículas de este semiconductor en el intervalo de 2-5 nm, la banda prohibida (esto es, la diferencia de energía entre la parte superior de la banda de valencia y la parte inferior de la banda de conducción) de este material se ajusta entre 4.5 y 2.5 eV (Alivisatos, 1996). La disminución del tamaño de las nanopartículas se traduce en un incremento del ancho de la banda prohibida. Esto se encuentra bien representado en el color fluorescente de la solución coloidal (Figura 3).
Figura 3 Fluorescencia de nanopartículas núcleo-coraza de CdSe-CdS con un diámetro de 1.7 nm (azul) a 6 nm (rojo).

Fuente: Adaptado de (Roduner, 2006) con el permiso de The Royal Society of Chemistry.
Por otro lado, las propiedades ópticas de partículas de metales nobles tienen su origen en la resonancia de plasmón superficial (RPS). El plasmón de superficie de un metal es una excitación colectiva de electrones de la banda de conducción y dominan las respuestas electromagnéticas de la estructura metálica en el orden de la resonancia plasmónica de longitud de onda. Este fenómeno sucede cuando un campo electromagnético interactúa con los electrones de la banda de conducción e induce una oscilación coherente de los electrones.
Como consecuencia, una intensa banda de absorción aparece en alguna región del espectro electromagnético dependiendo del tamaño de la partícula. Cuando un metal se encuentra en el campo oscilatorio de una radiación entrante, su nube de electrones empieza a oscilar (Figura 4). La forma y la posición de la banda de absorción dependen fuertemente del tamaño de la nanopartícula, de su forma, de la superficie y de la constante dieléctrica del medio que rodea a la partícula, por lo que la banda de absorción de las nanopartículas bimetálicas se verá afectada por el tipo de metales constituyentes, la composición elemental de las partículas y el arreglo atómico.
Figura 4 Resonancia plasmónica localizada en una esfera metálica.
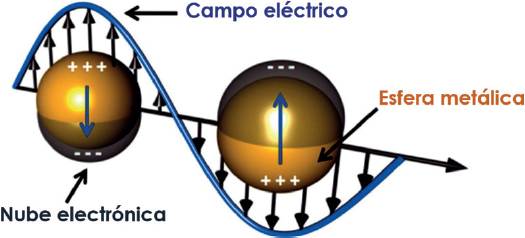
Fuente: Adaptado de Zaleska-Medynska et al. 2016. Copyright © 2016 con permiso de John Wiley & Sons, Inc.
Propiedades magnéticas
Las propiedades magnéticas de nanopartículas son cruciales para su exitoso desempeño en distintas áreas. Es importante crear nanopartículas con un magnetismo alto y regulable, especialmente saturación magnética (Ms) manteniendo un buen grado de monodispersión. Por décadas, las nanopartículas de Fe3O4 han servido como material modelo en el campo de la biomedicina, hoy en día los esfuerzos se encuentran enfocados en desarrollar nuevos materiales con propiedades magnéticas mejoradas. Como resultado de estos esfuerzos, partiendo de la fórmula general (M(X)+2O)(M(Y)2 +3O3) con M(X) y M(Y) = Fe en el caso de la magnetita, se han podido generar nuevos compuestos con mejores propiedades sustituyendo M(X) por Co, Ni, Mn, etc. El momento magnético debe ser lo suficientemente elevado para alcanzar una sensibilidad de señal elevada para tener un mejor contraste en la obtención de imágenes por resonancia magnética y para mejorar la eficiencia en su uso en hipertermia magnética (Mazarío et al., 2015).
En otros trabajos recientes se ha reportado la síntesis electroquímica de Fe3O4, NiFe2O4 y CoFe2O4 (Cabrera et al., 2008; Galindo et al., 2012; Mazario et al., 2012) de diferentes tamaños. En el caso de la ferrita de cobalto, varios estudios (Mazario et al., 2013) han concluido que un tamaño moderado y una alta anisotropía aseguran un mejor desempeño para las aplicaciones de hipertermia. Como resultado, el material es capaz de ordenarse magnéticamente en el bajo campo magnético fisiológico usando esta técnica. Por lo tanto, un material con anisotropía magnética moderada haría de este material un excelente candidato para su uso en aplicaciones biomédicas.
La ferrita de manganeso tiene una estructura tipo espinela mixta, dependiendo de la distribución catiónica en la estructura, desde espinela directa a espinela inversa. En particular, las propiedades de la ferrita provienen de la distribución de los cationes (Mn+2 y Fe+3) en los sitios tetra y octaédricos (Carta et al., 2010. Por ejemplo, las ferritas de manganeso reportadas en la literatura presentan una alta saturación magnética (aproximadamente 180.8 emu/g), una baja coercitividad (> 100 Oe), una moderada anisotropía y una alta relajación magnética nuclear debido a la gran magnitud del spin magnético (Lee et al., 2007; Fantechi et al., 2012). Estas propiedades son de gran importancia para propósitos clínicos porque permiten que el nivel de dosificación de las nanopartículas sonda se reduzca progresivamente.
Aplicaciones
Biomedicina
Las aplicaciones biomédicas dependen de las propiedades magnéticas de las nanopartículas, una de las aplicaciones más importantes de las nanopartículas magnéticas es la hipertermia magnética (Reddy et al., 2012).
La hipertermia es un método terapéutico en el tratamiento del cáncer, la cual consiste en aumentar la temperatura corporal. Busch y Coley (Busch, 1867; Coley, 1891) observaron la desaparición de sarcoma (un tipo de cáncer que se origina cuando las células en el cuerpo comienzan a crecer en forma descontrolada) después de una fiebre elevada. Con base en este estudio, las células cancerígenas son consideradas vulnerables a altas temperaturas. El crecimiento de estas células puede detenerse en un intervalo de temperaturas entre 41 y 46 °C por un periodo entre 20 y 60 min (Chiriac et al., 2015; Hervault y Thanh, 2014). Aunque esta técnica ha tenido avances significativos, también ha causado desaliento y frustración debido a los efectos indeseables asociados, como quemaduras, ampollas y el dolor asociado. Por lo tanto, la hipertermia es usada localmente, en lugar de exponer todo el cuerpo a altas temperaturas para superar los efectos colaterales del tratamiento. Sin embargo, este tratamiento no ha sido muy efectivo para curar otros tipos de cáncer debido a problemas asociados con hipertermia localizada como problemas en la distribución homogénea de la temperatura en el tumor y la incapacidad de prevenir el sobrecalentamiento en la región de tumores profundamente asentados. Por ello un nuevo método debe ser desarrollado para afrontar estos problemas. En este sentido, se ha propuesto el uso de nanotecnología para proporcionar un tratamiento sencillo, seguro y efectivo. Con el uso de nanopartículas magnéticas se podría producir calor para mejorar la eficiencia de la hipertermia. Técnicamente las nanopartículas metálicas pueden ser inyectadas localmente. Este procedimiento permite el calentamiento enfocado en las células afectadas, este proceso es llamado hipertermia magnética. En esta técnica se utilizan fluidos magnéticos como suspensiones coloidales para las nanopartículas.
El hierro, níquel y cobalto se encuentran entre las nanopartículas metálicas magnéticas más importantes debido a sus propiedades magnéticas (McNamara y Tofail, 2015; Lu et al., 2013), sin embargo, las desventajas son su poca estabilidad química y biocompatibilidad, así como una gran tendencia a oxidarse. Por ello, la adición de un segundo metal a las nanopartículas ayuda a mejorar la resistencia a la oxidación (Silke et al., 2006; Mary et al., 2014) en sistemas bimetálicos (a escala nanométrica) conservando sus propiedades magnéticas. Wu y colaboradores (Wu et al., 2013) reportaron la utilización de carbón para proteger y producir nanopartículas bimetálicas basadas en Fe, lo que proporciona estabilidad química y biocompatibilidad. En este sentido el uso de nanopartículas bimetálicas Fe-Co es un candidato prometedor debido a sus importantes propiedades magnéticas como una elevada saturación magnética (245 emu/g), una anisotropía magneto-cristalina y fuerzas coercitivas despreciables y una alta temperatura de Curie. Estas propiedades magnéticas hacen de este sistema nanobimetálico un candidato para el almacenamiento de datos de alta densidad, grabación magnética y liberación de fármacos (Eslami-Farsani et al., 2012).
Biosensores
Un biosensor puede ser definido como un dispositivo para la detección de un analito que acopla un elemento de biorreconocimiento a un transductor de señal para generar una señal eléctrica medible (Arnold y Meyerhoff, 1988; Kress-Rogers, 1996; Ronkainen et al., 2010) (Figura 5). Un biosensor consta de un elemento de medición que idealmente es capaz de detectar selectivamente (enlazar) en analito de interés cuando está presente en una matriz biológica compleja, un catalizador (si es necesario) para generar un segundo analito, y un transductor capaz de generar una respuesta. Varios nanomateriales, como nanopartículas de oro, nanotubos de carbono, nanopartículas magnéticas junto con materiales basados en grafeno (Marin y Merkoci, 2012; Kumar et al., 2015; Ratinac et al., 2011; Shao et al., 2010) son material de estudio como posibles candidatos como biosensores. El propósito de un biosensor es el de proporcionar información cuantitativa, en tiempo real, acerca de la composición química del ambiente en el cual el biosensor está situado (Rick et al., 2016). Los biosensores han sido diseñados para detectar y medir múltiples biomoléculas en diversas áreas como: el biomonitoreo de la exposición química para la evaluación de riesgos (dosimetría humana) (Lavecchia et al., 2010; Barry et al., 2009), la detección de patógenos transmitidos por el agua (Connelly y Baeumner, 2011), seguridad alimenticia (Wang et al., 2012; Patel, 2002; Ahmed et al, 2008; Kress-Rogers y Brimelow, 2001), diagnóstico y monitoreo fisiológico (Rodriguez-Mozaz et al., 2004; Qureshi et al., 2012; Pundir y Narang, 2013; Deisingh y Thompson, 2004; Windmiller y Wang, 2013; J. L. Wang et al., 2013; Wang, 2006 y 2008; Rhemrev-Boom et al., 2001; Kumar et al., 2015), monitoreo ambiental (Chiti et al., 2001; Lee y Gu, 2005; Jacobs et al., 2013; Nagaraj et al., 2014; Rodriguez-Mozaz et al., 2004), entre otros muchos.
Figura 5 Esquema generalizado de un biosensor.
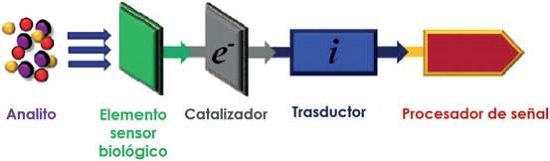
Fuente: Adaptado de (Rick et al., 2016).
Entre las múltiples aplicaciones de nanopartículas bimetálicas como biosensores, se pueden mencionar aquellas utilizadas en la prevención de la salud pública, por ejemplo, en la detección de colesterol por ser un factor importante de riesgo de enfermedades cardiovasculares.
Los biosensores para la determinación electroquímica del colesterol dependen ya sea del consumo de oxígeno o de la producción de H2O2 por el colesterol oxidasa inmovilizado. Por lo tanto, el uso de nanopartículas bimetálicas, capaces de afrontar problemas como efectos de interferencia y sobretensión, ofrecen una ruta para catalizar eficientemente la oxidación y reducción del H2O2 (Rick et al., 2016). Nanopartículas bimetálicas como Pt/Pd, Au/Pt (Safavi y Farjami, 2011; Cao et al., 2012) y Pt/Pd soportadas en TiO2-grafeno, han sido utilizadas para la detección del colesterol (Rick et al., 2016).
Cao y colaboradores (Cao et al., 2013) reportaron un nuevo biosensor electroquímico con una mayor sensibilidad en la detección de colesterol usando un electrodo de carbón vítreo constituido por un nanocomposito híbrido platino-paladio-chitosan-grafeno (Pt/Pd-CS-GS). Los autores mencionan que la presencia del nanocomposito Pt/Pd-CS-GS no sólo acelera la transferencia directa de electrones de la enzima redox a la superficie del electrodo, sino que también mejora la inmovilización del colesterol oxidasa. El biosensor tuvo una alta especificidad hacia el colesterol con la casi completa eliminación de la interferencia por ácido úrico, ácido ascórbico y glucosa. El mismo grupo, liderado por Cao, también desarrolló un sistema de detección de colesterol basado en nanocompositos Pt/Pd/TiO2-grafeno, el cual mostró un incremento del área superficial de detección y al mismo tiempo mejorando la velocidad de transmisión electrónica (Cao et al., 2013). Posteriormente se adicionó oro y colesterol oxidasa a este sistema, el biosensor fue entonces probado usando comida real como: huevo, carne, margarina y aceite de pescado. Este biosensor mostró tener potencial para ser utilizado como una herramienta sencilla para ser aplicado en el control de calidad y la detección de colesterol en alimentos (Cao et al., 2013).
Safavi y colaboradores (Safavi y Farjami, 2011) utilizaron un método de electrodepósito para formar nanopartículas Au/Pt sobre un electrodo de carbón vítreo (GCE) modificado con una mezcla de líquido iónico (LI) y chitosan (Ch) (Au/Pt-Ch-LI/GCE). Ellos reportaron que el Au/Pt-Ch-LI/GCE electrocataliza la reducción de H2O2 haciéndolo adecuado para la preparación de biosensores, mientras que el entrecruzamiento del chitosan y el colesterol oxidasa se utilizó para inmovilizar la enzima en la superficie del electrodo. Además, mostraron que la adición de especies potencialmente interferentes, como ácido ascórbico y glucosa (1 mM de ambos), no mostró ningún cambio en la corriente de respuesta del colesterol.
Catálisis
La catálisis es la aplicación más importante de las nanopartículas metálicas y es un tema extensamente estudiado. La combinación de dos metales (a escala nanométrica) en la ciencia de la catálisis ha resultado en una mejora en la actividad, selectividad y/o estabilidad. Las modificaciones electrónicas o geométricas se pueden lograr ajustando la estructura bimetálica, la composición en la superficie y la distribución y tamaño de partícula (Wang et al., 2013).
Los catalizadores bimetálicos son ampliamente utilizados en reacciones de oxidación como lo son: la oxidación de glucosa (Zhang et al., 2011; Godínez-Salomón et al., 2012), CO (Han et al., 2014; Zhang et al., 2014; Duan et al., 2013), distintos alcoholes (Deplanche et al., 2012; Balcha et al., 2011; Fu et al., 2014), tolueno (Hosseini et al., 2012); reacciones de reducción como la reducción de oxígeno (Yamamoto et al., 2011; Watanabe y Motoo, 1975) y la reducción de NOx; reacciones de deshidrogenación como la deshidrogenación de propano (Han et al., 2014); reacciones de hidrogenación como la hidrogenación de compuestos nitro-aromáticos (Wei et al., 2014); reacciones de desulfuración como la desulfuración de tiofeno (Suo et al., 2011); entre innumerables ejemplos más. Algunos nanomateriales como Pt o Pd, así como el Au y Ag, tienen una excepcional actividad catalítica.
En el caso del platino, el principal objetivo de combinarlo con otro metal es el de generar una mejor actividad catalítica y evitar el envenenamiento de la superficie del catalizador (como la formación de coque). Por ejemplo, se ha reportado que la adición de Cu en catalizadores de Pt (Pt-Cu/Al2O3) previene la formación de coque en la reacción de deshidrogenación de propano (Han et al., 2014). Se reportó que la adición de 0.5% en peso de Cu es una cantidad óptima para aumentar su selectividad a propileno hasta un 90.8% y el rendimiento hasta 36.5%. La interacción entre los átomos de Pt y Cu inhibe la adsorción de las moléculas de propileno y aumenta la barrera de energía de la ruptura del enlace C-C. Una menor adsorción de propileno reduce la posibilidad de la formación de coque, además, el incremento de la barrera energética suprime la formación de metano (Han et al., 2014).
Otro ejemplo es la mezcla de Pt-Pd en forma de nanocubos cóncavos que ha mostrado ser un catalizador prometedor para la oxidación de metanol (Zhan et al., 2014). Los nanotubos Pt-Pd fueron sintetizados mediante una combinación de sustitución galvánica y coproducción en una solución de etilenglicol conteniendo los precursores metálicos, poli-vinil pirrolidona, ácido ascórbico y KBr. Se observó que la actividad aumentó al incrementar el porcentaje de Pt. La aleación Pd40Pt60 mostró la más alta actividad, la cual fue atribuida a que se mejoró la tolerancia al envenenamiento de la superficie por adsorción de CO. El platino ayudó en la deshidrogenación de metanol formando especies Pt-CO, mientras que el paladio catalizó la deshidrogenación del agua formando Pd-OH, dando como resultado la eliminación del CO fuertemente adsorbido en los sitios activos de la reacción entre Pt-CO y Pd-OH (Zhan et al., 2014).
En el Grupo de Materiales y Nanotecnología y en el Laboratorio Universitario de Nanotecnología Ambiental (LUNA) ambos del Centro de Ciencias Aplicadas y Desarrollo Tecnológico (CCADET) se han preparado diferentes catalizadores bimetálicos a base de oro soportados principalmente en dióxido de titanio (TiO2) utilizando el depósito secuencial o la coprecipitación de los metales mediante el uso del método de depósito-precipitación con urea (DPU). Se han estudiado diferentes tipos de sistemas, como aquellos que son completamente miscibles con el Au como Au-Ag (Sandoval et al., 2011) el cual fue preparado por un depósito secuencial por DPU (primero la plata y luego el oro). Los catalizadores Au-Ag/TiO2 (~ 4 nm) mostraron una mayor estabilidad en la reacción de oxidación de CO que el catalizador monometálico de Au a 20 °C debido a un efecto sinérgico en el que la plata activa la molécula de oxígeno que reacciona con el CO adsorbido en el oro. El catalizador con una proporción atómica Au:Ag de 1:0.37 mostró la más alta actividad catalítica. Además, se mostró que al aumentar la temperatura de activación en hidrógeno se favorece el mezclado (aleación) de los metales en nanopartículas. Sin embargo, hay otros sistemas, como la aleación nanométrica oro-cobre, que han mostrado una menor actividad en reacciones de oxidación que el catalizador monometálico Au/TiO2 (Sandoval et al., 2013), probablemente debido al enriquecimiento de la superficie de las partículas con átomos de Cu. En contraste, las muestras Au-Cu calcinadas en las que se formaron fases del tipo Au-CuO/TiO2 produjeron catalizadores altamente activos y estables en la reacción de oxidación de CO, mostrando una actividad 4 veces mayor que la de la muestra monometálica de Au/TiO2, esto es debido a que las partículas de oro están directamente en interacción con partículas de CuO, mismas que se comportan como un mejor soporte para activar al O2 que el TiO2.
También, se han estudiado sistemas que (a nivel másico) son parcialmente miscibles como Au-Ni (Aguilar-Tapia et al., 2016). Los catalizadores Au-Ni/TiO2 (~ 3 nm) fueron preparados por medio de la co-precipitación de los metales usando la técnica DPU y se confirmó la formación de nanopartículas bimetálicas utilizando STEM-XEDS. Estos catalizadores fueron evaluados en la hidrogenación selectiva de 1,3 butadieno (hacia butenos) sin llegar a la hidrogenación completa (butano). Se observó que variando la composición de los metales es posible regular la actividad y selectividad y el catalizador con la menor cantidad de Ni (relación atómica Au:Ni de 1:0.08) mostró el mejor compromiso entre la actividad catalítica proporcionada por el Ni y la selectividad hacia butenos proporcionada por el Au.
Además, se han estudiado sistemas inmiscibles (en estado másico) como Au-Ir (Aguilar-Tapia et al., 2015); sin embargo, se ha mostrado que a escala nanométrica las propiedades de estos metales cambian, haciendo posible la formación de nanopartículas bimetálicas que contienen estos metales. Los catalizadores Au-Ir/TiO2 (2-3 nm) fueron preparados por medio de un depósito secuencial (primero Ir y después Au) por DPU. Estos catalizadores fueron probados en la reacción de descomposición (combustión catalítica) de propeno, como molécula sonda de compuestos orgánicos volátiles. Se reportó que las condiciones de activación de estos catalizadores son un factor importante, al ser tratados térmicamente con hidrógeno a 400 °C se obtuvo la mayor actividad catalítica. La mejora en las características de los catalizadores bimetálicos Ir-Au/TiO2 fue atribuida a un efecto sinérgico entre el oro y el iridio en forma metálica (Au0-Ir0). Se observó que el oro evita la reoxidación del iridio durante la reacción, lo que además brinda una mayor estabilidad.
Celdas de combustible
El suministro de energía es un tema importante para la sociedad debido al agotamiento de los combustibles fósiles tradicionales. Por lo tanto, el desarrollo de celdas de combustible ha sido un tema de gran interés en los últimos años. En este aspecto, las celdas de combustible de alcohol directo (CCAD), las cuales convierten directamente energía química a energía eléctrica son prometedoras candidatas como nuevas fuentes de energía debido a su alta eficiencia, la alta densidad eléctrica y que son amigables con el medio ambiente, especialmente para dispositivos electrónicos portátiles y aplicaciones de transporte (Antolini, 2007; Ren et al., 2000; Antolini y Gonzalez, 2010; Tiwari et al., 2013; Rabis et al., 2012). Además el almacenamiento y transporte de alcoholes (como metanol, etanol y etilenglicol) es mucho más fácil en comparación con el hidrógeno (Yin et al., 2014). Las CCAD producen electricidad mediante la oxidación electroquímica de alcoholes. En la Figura 6 se muestra una celda de combustible directa de metanol (CCDM).
Figura 6 Componentes típicos en una celda de combustible directa de metanol (CCDM).
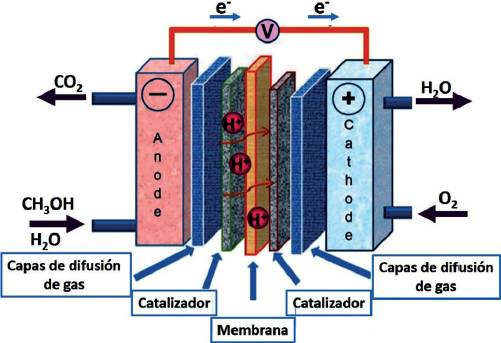
Fuente: Adaptado de Yin et al., 2014 con el permiso de The Royal Society of Chemistry.
Los catalizadores en los electrodos consisten en nanopartículas de metales nobles (principalmente Pd) depositadas en soportes porosos y son factor clave en el costo y eficiencia de las CCDA. La reacción de reducción del oxígeno y la reacción de oxidación del alcohol ambas ocurren en la superficie del catalizador. Uno de los problemas con estos sistemas es el alto costo del paladio; por lo tanto, se ha propuesto la preparación de nuevos catalizadores con una menor cantidad de paladio y una de las propuestas es la disminución de este metal, por medio de la adición de un segundo metal (Pd-M, donde M = Cu, Ag, Au, etc.) (Yin et al., 2014).
La adición de un segundo metal para formar sistemas bimetálicos no sólo disminuye la cantidad de platino en los catalizadores (y por tanto el costo), sino que también modifica las propiedades electrónicas y cristalográficas del Pd, lo que modifica también la energía de enlace entre el Pd y la molécula reactante, o la energía de absorción del Pd y los intermediarios de la electro-reacción, y, como resultado, una mejora en el rendimiento catalítico (Sankar et al., 2012; Tao, 2012; Lim et al., 2009).
Recientemente Yu y colaboradores desarrollaron una ruta fácil para sintetizar nanocubos PdCu con un tamaño promedio de 12 nm utilizando PdCl2 y Cu(acac)2 en oleilamina como solvente y trioctilfosfina como estabilizador, las cuales son altamente activas para reducir oxígeno (2 veces mayor que los catalizadores comerciales Pt/C) (Gao et al., 2013). En el caso del sistema bimetálico Au-Pd, se ha reportado la preparación de nanopartículas con estructura tipo núcleo-coraza (Au@Pd), en el cual primero se sintetizaron las nanopartículas de Au (núcleo) seguido de un procedimiento de transferencia en tres fases para el recubrimiento de paladio (coraza). Se ha demostrado que estas nanopartículas bimetálicas son más de 40 veces más activas que los catalizadores monometálicos de Pd en la oxidación de metanol. También se ha demostrado su excelente estabilidad (alrededor de 7 veces más estable que catalizadores de Pd) (Tan et al., 2012).
Se ha reportado la formación de nanopartículas bimetálicas Ag-Pd uniformes (∼5 nm) en un amplio intervalo de composiciones mediante la termólisis simultánea de los precursores metálicos (Slanac et al., 2012). En el caso de catalizadores con aleaciones ricas en Ag, la superficie de los catalizadores contiene monoátomos de Pd rodeados de átomos de Ag, lo cual maximiza la actividad de cada átomo de Pd. Se encontró que la capacidad de reducción de oxígeno de catalizadores con composiciones Ag9Pd y Ag4Pd fue hasta 2.7 y 3.2 veces superior que los valores esperados para los sistemas monometálicos como resultado de la alta sinergia en la actividad catalítica.
Conclusión
En las últimas décadas, la síntesis controlada de nanopartículas bimetálicas ha atraído la atención en diferentes disciplinas, debido a su eficiencia en diferentes aplicaciones, como los son la catálisis, aplicaciones biomédicas, su uso como biosensores o en celdas de combustible, entre muchos otras. Utilizando los métodos de síntesis y las caracterizaciones adecuadas, es posible obtener nanomateriales bimetálicos bien definidos y con propiedades mejoradas y diferentes a sus contrapartes individuales, debido a efectos geométricos y/o electrónicos (y que pueden generar efectos sinérgicos) que son el resultado al mezclar los dos metales y cuyas aplicaciones son de gran utilidad en el desarrollo tecnológico. Sin embargo, este campo aún requiere de un mejor entendimiento de los mecanismos de reacción que ocurren en la superficie de las nanopartículas bimetálicas (en el caso de la catálisis) o, de manera general, la forma en que éstas interaccionan con el medio, por lo que es importante seguir desarrollando estrategias de preparación y caracterización de estos materiales, para comprender mejor la relación síntesis-estructura-propiedad lo cual está determinado por parámetros como el tamaño de partícula, su forma, composición final y el arreglo atómico, lo cual puede conducir a mejorar las propiedades de los nanomateriales bimetálicos.
Referencias
- Aguilar-Tapia, A. et al. (2016). Selective hydrogenation of 1,3-butadiene over bimetallic Au-Ni/TiO2 catalysts prepared by deposition-precipitation with urea. Journal of Catalysis, vol. 344, núm. 3, 515-523.
- Aguilar-Tapia, A. et al. (2015). Synergistic effects of Ir-Au/TiO2 catalysts in the total oxidation of propene: Influence of the activation conditions. Physical Chemistry Chemical Physics, vol. 17, núm. 42, 28022-28032.
- Ahmed, M. U., Hossain, M. M. y Tamiya, E. (2008). Electrochemical biosensors for medical and food applications. Electroanalysis, vol. 20, núm. 6, 616-626.
- Alayoglu, S. et al. (2011). Surface Composition and Catalytic Evolution of AuxPd1−x (x = 0.25, 0.50 and 0.75) Nanoparticles Under CO/O2 Reaction in Torr Pressure Regime and at 200 °C. Catalysis Letters, vol. 141, núm. 5, 633-640.
- Alivisatos, A. P. (1996). Semiconductor clusters, nanocrystals, and quantum dots. Science, vol. 271, núm. 5251, 933-937.
- Antolini, E. (2007). Catalysts for direct ethanol fuel cells. Journal of Power Sources, vol. 170, núm. 1, 1-12.
- Antolini, E. y Gonzalez, E. R. (2010). Alkaline direct alcohol fuel cells. Journal of Power Sources, vol. 195, núm. 11, 3431-3450.
- Arnold, M. A. y Meyerhoff, M. E. (1988). Recent advances in the development and analytical applications of biosensing probes. Critical Reviews Analytical Chemistry, vol. 20, núm. 3, 149-196.
- Balcha, T. et al. (2011). Selective aerobic oxidation of crotyl alcohol using AuPd core-shell nanoparticles. ACS Catalysis, vol. 1, núm. 5, 425-436.
- Banadaki, A. D. y Kajbafvala, A. (2014). Recent advances in facile synthesis of bimetallic nanostructures: An overview. Journal of Nanomaterials, vol. 2014, 1-28.
- Banin, U. (2007). Nanocrystals: Tiny seeds make a big difference. Nature Materials, vol. 6, núm. 9, 625-626.
- Barry, R. C. et al. (2009). Nanotechnology-based electrochemical sensors for biomonitoring chemical exposures. Journal of Exposure Science and Environmental Epidemiology, vol. 19, núm. 1, 1-18.
- Busch, W. (1867). Aus der sitzung der medicinischen. Berl KlinWochenschr, vol. 13, núm. 5, 137.
- Cabrera, L. et al. (2008). Magnetite nanoparticles: Electrochemical synthesis and characterization. Electrochim Acta, vol. 53, núm. 8, 3436-3411.
- Cao, S. et al. (2012). An integrated sensing system for detection of cholesterol based on TiO2-graphene-Pt-Pd hybrid nanocomposites. Biosensors and Bioelectronics, vol. 42, 532-538.
- Cao, S. et al. (2013). Electrochemistry of cholesterol biosensor based on a novel Pt- Pd bimetallic nanoparticle decorated graphene catalyst. Talanta, vol. 109, 167-172.
- Carta, D. et al. (2010). Synthesis and microstructure of manganese ferrite colloidal nanocrystals. Physical Chemistry Chemical Physics, vol. 12, núm. 19, 5074-5083.
- Chiriac, H. et al. (2015). In vitro cytotoxicity of Fe-Cr-Nb-B magnetic nanoparticles under high frequency electromagnetic field. Journal of Magnetism and Magnetic Materials, vol. 380, 13-19.
- Chiti, G., Marrazza, G. y Mascini, M. (2001). Electrochemical DNA biosensor for environmental monitoring. Analytica Chimica Acta, vol. 427, núm. 2, 155-164.
- Coley, W. B. (1891). Contribution to the knowledge of sarcoma. Annals of Surgery, vol. 14, núm. 3, 199-220.
- Connelly, J. T. y Baeumner, A. J. (2011). Biosensors for the detection of waterborne pathogens. Analytical and Bioanalytical Chemistry, vol. 402, núm. 1, 117-127.
- Deisingh, A. K. y Thompson, M. (2004). Biosensors for the detection of bacteria. Canadian Journal of Microbiology, vol. 50, núm. 2, 69-77.
- Deplanche, K. et al. (2012). Microbial synthesis of core/shell gold/palladium nanoparticles for applications in green chemistry. Journal of The Royal Society Interface, vol. 9, núm. 72, 1705-1712.
- Duan, M.-Y. et al. (2013). Self-assembly of Au-Pt core-shell nanoparticles for effective enhancement of methanol electrooxidation. Electrochimica Acta, vol. 87, 432-437.
- Eslami-Farsani, R. et al. (2012). Mechanical characterization of nanoclay reinforced polypropylene composites at high temperature subjected to tensile loads. Advanced Materials Research, vol. 488-489, 567-571.
- Fantechi, E. et al. (2012). Exploring the effect of co doping in fine maghemite nanoparticles. Journal of Physical Chemistry C, vol. 116, núm. 14, 8261-8270.
- Ferrando, R., Jellinek, J. & Johnston, R. L. (2008). Nanoalloys: From theory to applications of alloy clusters and nanoparticles. Chemical Reviews, vol. 108, núm. 3, 845-910.
- Fu, G.-T. et al. (2014). Hydrothermal synthesis of Pt-Ag alloy nano-octahedra and their enhanced electrocatalytic activity for the methanol oxidation reaction. Nanoscale, vol. 6, núm. 21, 12310-12314.
- Galindo, R. et al. (2012). Electrochemical synthesis of NiFe2O4 nanoparticles: Characterization and their catalytic applications. Journal of Alloys and Compound, vol. 536, S241-S244.
- Gao, Q. et al. (2013). Shape-controlled synthesis of monodisperse PdCu nanocubes and their electrocatalytic properties. ChemSusChem, vol. 6, núm. 10, 1878-1882.
- Ge, Q. et al. (1998). Bifunctional catalysts for conversion of synthesis gas to dimethyl ether. Applied Catalysis A: General, vol. 167, núm. 1, 23-30.
- Godínez-Salomón, F., Hallen-López, M. y Solorza-Feria, O. (2012). Enhanced electroactivity for the oxygen reduction on Ni@Pt core-shell nanocatalysts. International Journal of Hydrogen Energy, vol. 37, núm. 19, 14902-14910.
- Han, Z. et al. (2014). Propane dehydrogenation over Pt-Cu bimetallic catalysts: The nature of coke deposition and the role of copper. Nanoscale, vol. 6, núm. 17, 10000-10008.
- Harikumar, K. R., Ghosh, S. y Rao, C. N. R. (1997). X-ray photoelectron spectroscopic investigations of Cu-Ni, Au-Ag, Ni-Pd, and Cu-Pd bimetallic clusters. Journal of Physical Chemistry A, vol. 101, núm. 4, 536-540.
- Hervault, A. y Thanh, N. T. K. (2014). Magnetic nanoparticle-based therapeutic agents for thermo-chemotherapy treatment of cancer. Nanoscale, vol. 6, núm. 20, 11553-11573.
- Hosseini, M. et al. (2012). Catalytic performance of core-shell and alloy Pd-Au nanoparticles for total oxidation of VOC: The effect of metal deposition. Applied Catalysis B: Environmental, vol. 111-112, 218-224.
- Jacobs, M. et al. (2013). An electrochemical sensor for the detection of antibiotic contaminants in water. Analytical Methods, vol. 5, núm. 17, 4325-4329.
- Kodama, D., Shinoda, K. y Sato, K. (2006). Chemical synthesis of sub-micrometerto nanometer-sized magnetic FeCo Dice. Advanced Materials, vol. 18, núm. 23, 3154-3159.
- Kress-Rogers, E. (1996). Handbook of biosensors and electronic noses: Medicine, food, and the environment, Nueva York, NY, USA: CRC Press Inc.
- Kress-Rogers, E. y Brimelow, C. J. B. (2001). Instrumentation and sensors for the food industry, 2a ed., Cambridge, UK: Woodhead.
- Kumar, S. et al. (2015). Graphene, carbon nanotubes, zinc oxide and gold as elite nanomaterials for fabrication of biosensors for healthcare. Biosensors and Bioelectronics, vol. 70, 498-503.
- Lavecchia, T., Tibuzzi, A. y Giardi, M. T. (2010). Biosensors for functional food safety and analysis. Bio-farms. Advances in Experimental Medicine and Biology, vol. 698, 267-281.
- Lee, J.-H. et al. (2007). Artificially engineered magnetic nanoparticles for ultra-sensitive molecular imaging. Nature Medicine, vol. 13, núm. 1, 95-99.
- Lee, J.-H. y Gu, M. B. (2005). An integrated mini biosensor system for continuous water toxicity monitoring. Biosensors and Bioelectronics, vol. 20, núm. 9, 1744-1749.
- Lim, B. et al. (2009). Pd-Pt bimetallic nanodendrites with high activity for oxygen reduction. Science, vol. 324, núm. 5932, 1302-1305.
- Lu, L.-Y. et al. (2013). Monodisperse magneticmetallic nanoparticles: Synthesis, performance enhancement, and advanced applications. Rare Metals, vol. 32, núm. 4, 323-331.
- Mallin, M. P. y Murphy, C. J. (2002). Solution-phase synthesis of sub-10nm Au-Ag alloy nanoparticles. Nano Letters, vol. 2, núm. 11, 1235-1237.
- Marin, S. y Merkoci, A. (2012). Nanomaterials based electrochemical sensing applications for Safety and Security. Electroanalysis, vol. 24, núm. 3, 459-469.
- Mary, J. A. et al. (2014). Structure and magnetic properties of Cu-Ni alloy nanoparticles prepared by rapid microwave combustion method. Transactions of Nonferrous Metals Society of China, vol. 24, núm. 5, 1467-1463.
- Massicot, F. et al. (2000). Synergistic effect in bimetallic Ni-Al clusters. Application to efficient catalytic reductive dehalogenation of polychlorinated arenes. Tetrahedron, vol. 56, núm. 27, 4765-4768.
- Mayer, K. M. & Hafner, J. H. (2011). Localized surface plasmon resonance sensors. Chemical Reviews, vol. 111, 3828-3857.
- Mazario, E. et al. (2013). Magnetic hyperthermia properties of electrosynthesized cobalt ferrite nanoparticles. Journal of Physical Chemistry C, vol. 117, núm. 21, 11405-11411.
- Mazario, E. et al. (2012). Synthesis and characterization of CoFe2O4 ferrite nanoparticles obtained by an electrochemical method. Nanotechnology, vol. 23, núm. 35, 355708-355713.
- Mazario, E. et al. (2015). High specific absorption rate and transverse relaxivity effects in manganese ferrite nanoparticles obtained by an electrochemical route. Journal of Physical Chemistry C, vol. 119, núm. 12, 6828-6834.
- McNamara, K. y Tofail, S. A. M. (2015). Nanosystems: The use of nanoalloys, metallic, bimetallic, and magnetic nanoparticles in biomedical applications. Physical Chemistry Chemical Physics, vol. 17, núm. 42, 27981-27995.
- Mu, R., Fu, Q. y Xu, H. (2011). Synergetic effect of surface and subsurface Ni species at Pt-Ni bimetallic catalysts for CO oxidation. Journal of American Chemical Society, vol. 133, núm. 6, 1978-1986.
- Nagaraj, V. J. et al. (2014). Nanochannel-based electrochemical sensor for the detection of pharmaceutical contaminants in water. Environmental Science: Processes & Impacts, vol. 16, núm. 17, 135-140.
- Nutt, M. O., Hughes, J. B. y Wong, M. S. (2006). Designing Pd on-Au bimetallic nanoparticle catalysts for trichloroethene hydrodechlorination. Environmental Science and Technology, vol. 39, núm. 5, 1346-1353.
- Patel, P. D. (2002). (Bio)sensors for measurement of analytes implicated in food safety: A review. TrAC Trends in Analytical Chemistry, vol. 21, núm. 2, 96-115.
- Ponec, V. (2001). Alloy catalysts: The concepts. Applied Catalysis A: General, vol. 222, núm. 1-2, 31-45.
- Pundir, C. S. y Narang, J. (2013). Determination of triglycerides with special emphasis on biosensors: A review. International Journal of Biological Macromolecules, vol. 61, 379-389.
- Qureshi, A., Gurbuz, Y. y Niazi, J. H. (2012). Biosensors for cardiac biomarkers detection: A review. Sensors and Actuators B: Chemical, vol. 171-172, 62-76.
- Rabis, A., Rodriguez, P. y Schmidt, T. J. (2012). Electrocatalysis for polymer electrolyte fuel cells: Recent achievements and future challenges. ACS Catalysis, vol. 2, núm. 5, 864-890.
- Ratinac, K. R. et al. (2011). Graphene and related materials in electrochemical sensing. Electroanalysis, vol. 23, núm. 4, 803-826.
- Reddy, L. H. et al. (2012). Magnetic nanoparticles: Design and characterization, toxicity and biocompatibility, pharmaceutical and biomedical applications. Chemical Reviews, vol. 112, núm. 11, 5818-5878.
- Ren, X. et al. (2000). Recent advances in direct methanol fuel cells at Los Alamos National Laboratory. Journal of Power Sources, vol. 86, núm. 1-2, 111-116.
- Renzas, J. R. et al. (2011). Rh1−xPdx nanoparticle composition dependence in CO oxidation by oxygen: Catalytic activity enhancement in bimetallic systems. Physical Chemistry Chemical Physics, vol. 13, núm. 7, 2556-2562.
- Rhemrev-Boom, M. M. et al. (2001). A versatile biosensor device for continuous biomedical monitoring. Biosensors and Bioelectronics, vol. 16, núm. 9-12, 839- 847.
- Rick, J., Tsai, M. y Hwang, B. (2016). Biosensors incorporating bimetallic nanoparticles. Nanomaterials, vol. 6, núm. 1, 1-30.
- Rodriguez-Mozaz, S. et al. (2004). Biosensors for environmental monitoring of endocrine disruptors: A review article. Analytical and Bioanalytical Chemistry, vol. 378, 588-598.
- Roduner, E. (2006). Size matters: Why nanomaterials are different. Chemical Society Reviews, vol. 35, núm. 7, 583-592.
- Ronkainen, N. J., Halsall, H. B. y Heineman, W. R. (2010). Electrochemical biosensors. Chemical Society Reviews, vol. 39, núm. 5, 1747-1763.
- Rui, H. et al. (2010). Synthesis, functionalization, and biomedical applications of multifunctional magnetic nanoparticles. Advanced Materials, vol. 22, núm. 25, 2729-2742.
- Safavi, A. y Farjami, F. E. (2011). Electrodeposition of gold-platinum alloy nanoparticles on ionic liquid-chitosan composite film and its application in fabricating an amperometric cholesterol biosensor. Biosensors and Bioelectronics, vol. 26, núm. 5, 2547-2552.
- Sandoval, A. et al. (2011). Bimetallic Au-Ag/TiO2 catalyst prepared by deposition - precipitation : High activity and stability in CO oxidation. Journal of Catalysis, vol. 281, núm. 1, 40-49.
- Sandoval, A., Louis, C., Zanella, R. (2013). Improved activity and stability in CO oxidation of bimetallic Au-Cu/TiO2 catalysts prepared by deposition-precipitation with urea, Applied Catalysis B vol. 140-141, 363-377
- Sankar, M. et al. (2012). Designing bimetallic catalysts for a green and sustainable future. Chemical Society Reviews, vol. 41, 8099-8139.
- Sau, T. K. y Rogach A. L. (2010). Nonspherical noblemetal nanoparticles: Colloid-chemical synthesis and morphology control. Advanced Materials, vol. 22, núm. 16, 1781-1804.
- Scott, R. W. J., Datye, A. K. y Crooks, R. M. (2003). Bimetallic palladium-platinum dendrimer-encapsulated catalysts. Journal of American Chemical Society, vol. 125, núm. 13, 3708-3709.
- Shao, Y. Y. et al. (2010). Graphene based electrochemical sensors and biosensors: A review. Electroanalysis, vol. 22, núm. 10, 1027-1036.
- Silke, B. et al. (2006). Surface engineering of Co and FeCo nanoparticles for biomedical application. Journal of Physics: Condensed Matter, vol. 18, núm. 38, S2543-S2561.
- Slanac, D. A. et al. (2012). Atomic ensemble and electronic effects in Ag-Rich AgPd nanoalloy catalysts for oxygen reduction in alkaline media. Journal of American Chemical Society, vol. 134, núm. 23, 9812-9819.
- Sobal, N. S. et al. (2003). Synthesis of core-shell PtCo nanocrystals. Journal of Physical Chemistry B, vol. 107, núm. 30, 7351-7354.
- Somorjai, G. A., Tao, F. y Park, J. Y. (2008) The Nanoscience revolution: Merging of colloid science, catalysis and nanoelectronics. Topics in Catalysis, vol. 47, núm. 1, 1-14.
- Suo, Z. et al. (2011). Structure and activity of Au-Pd/SiO2 bimetallic catalyst for thiophene hydrodesulfurization. Fuel Processing Technology, vol. 92, núm. 8, 1549-1553.
- Tan, Q. et al. (2012). Highly efficient and stable nonplatinum anode catalyst with Au@Pd core-shell nanostructures for methanol electrooxidation. Journal of Catalysis, vol. 295, 217-222.
- Tao, F. et al. (2010). Evolution of structure and chemistry of bimetallic nanoparticle catalysts under reaction conditions. Journal of American Chemical Society, vol. 132, núm. 25, 8697-8703.
- Tao, F. et al. (2008). Reaction-driven restructuring of Rh-Pd and Pt-Pd core-shell nanoparticles. Science, vol. 322, núm. 5903, 932-934.
- Tao, F. (2012). Synthesis, catalysis, surface chemistry and structure of bimetallic nanocatalysts. Chemical Society Reviews, vol. 41, núm. 41, 7977-7979.
- Tiwari, J. N. et al. (2013). Recent progress in the development of anode and cathode catalysts for direct methanol fuel cells. Nano Energy, vol. 2, núm. 5, 553-578.
- Toshima, N. y Yonezawa, T. (1998). Bimetallic nanoparticles-novel materials for chemical and physical applications. New Journal of Chemistry, vol. 22, núm. 11, 1179-1201.
- Wang, A. et al. (2013). Understanding the synergistic effects of gold bimetallic catalysts. Journal of Catalysis, vol. 308, 258-271.
- Wang, D. et al. (2008). Ag, Ag2S, and Ag2Se nanocrystals: Synthesis, assembly, and construction of mesoporous structures. Journal of American Chemical Society, vol. 130, núm. 12, 4016-4022.
- Wang, J. (2006). Electrochemical biosensors: Towards point-of-care cancer diagnostics. Biosensors and Bioelectronics, vol. 21, núm. 10, 1887-1892.
- Wang, J. (2008). Electrochemical glucose biosensors. Chemical Reviews, vol. 108, núm. 2, 814-825.
- Wang, J. L. et al. (2013). Advances in nano-scaled biosensors for biomedical applications. The Analyst, vol. 138, núm. 16, 4427-4435.
- Wang, Y. X., Ye, Z. Z. y Ying, Y. B. (2012). New trends in impedimetric biosensors for the detection of foodborne pathogenic bacteria. Sensors, vol. 12, núm. 3, 3449-3471.
- Watanabe, M. y Motoo, S. (1975). Electrocatalysis by ad-atoms: Part II. Enhancement of the oxidation of methanol on platinum by ruthenium ad-atoms. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, vol. 60, 267-273.
- Wei, Y. et al. (2014). Multifunctional catalysts of three-dimensionally ordered macroporous oxide-supported Au@Pt core-shell nanoparticles with high catalytic activity and stability for soot oxidation. Journal of Catalysis, vol. 317, 62-74.
- Windmiller, J. R. y Wang, J. (2013). Wearable electrochemical sensors and biosensors: A review. Electroanalysis, vol. 25, núm. 1, 29-46.
- Wu, A., Yang, X. y Yang, H. (2013). Magnetic properties of carbon-encapsulated Fe-Co alloy nanoparticles. Dalton Transactions, vol. 42, núm. 14, 4978-4984.
- Yamamoto, T. A. et al. (2011). Methanol oxidation catalysis and substructure of PtRu/C bimetallic nanoparticles synthesized by a radiolytic process. Applied Catalysis A: General, vol. 396, núm. 1-2, 68-75.
- Yin, Z., Lin, L. y Ma, D. (2014). Construction of Pd-based nanocatalysts for fuel cells: Opportunities and challenges. Catalysis Science & Technology, vol. 4, núm. 12, 4116-4128.
- Zaleska-Medynska, A. et al. (2016). Noble metal-based bimetallic nanoparticles: the effect of the structure on the optical, catalytic and photocatalytic properties. Advances in Colloid and Interface Science, vol. 229, 80-107.
- Zhan, F. et al. (2014). Facile synthesis of Pd-Pt alloy concave nanocubes with high- index facets as electrocatalysts for methanol oxidation. CrystEngComm, vol. 16, 2411-2416.
- Zhang, H., Okuni, J. y Toshima, N. (2011). One-pot synthesis of Ag-Au bimetallic nanoparticles with Au shell and their high catalytic activity for aerobic glucose oxidation. Journal of Colloid and Interface Science, vol. 354, núm. 1, 131-138.
- Zhang, J. et al. (2014). Highly active PtAu alloy nanoparticle catalysts for the reduction of 4-nitrophenol. Nanoscale, vol. 6, núm. 4, 2125-2130.