www.mundonano.unam.mx | Mundo Nano
http://dx.doi.org/10.22201/ceiich.24485691e.2017.19.62403 | 10(19), 26-36, julio–diciembre 2017
Artículos
Nanotecnología, nanomedicina, cáncer y diabetes
Inés Rauschert*
Ana Zambrana**
Verónica Bervejillo**
Andrés Alberro**
Rocío Varela**
Juan C. Benech*,**,***
* Plataforma de Microscopía de Fuerza Atómica, Instituto de Investigaciones Biológicas Clemente Estable. Av. Italia 3318, CP 11600, Montevideo, Uruguay. +5982 4871616 int 107. (irauschert@iibce.edu.uy)
** Laboratorio de Señalización Celular y Nanobiología, Instituto de Investigaciones Biológicas Clemente Estable. (azambrana@iibce.edu.uy); (vbervejillo@iibce.edu.uy); (rvarela@iibce.edu.uy); (aalberro@iibce.edu.uy); (jbenech@iibce.edu.uy).
*** Autor de correspondencia. Director del Laboratorio de Señalización Celular y Nanobiología. Responsable de la Plataforma de MFA. Tel: +598 24871616, int 107 Correos: (jbenech@iibce.edu.uy o); (juancloaudio.benech@gmail.com).
Resumen:
Dados los avances tecnológicos recientes, las ciencias biomédicas buscan por medio de la nanotecnología nuevas posibilidades de tratamientos y herramientas de diagnóstico. Estos avances tecnológicos hacen posible estudiar la mecánica de material biológico vivo y su relación con procesos biológicos o moleculares.
Una de las líneas de investigación que se desarrolla en nuestro laboratorio es estudiar el efecto que distintas patologías tienen en la nanomecánica celular. En particular, utilizando herramientas nanotecnológicas como el microscopio de fuerza atómica, hemos constatado que la rigidez celular se modifica en el caso del neuroblastoma y de la cardiomiopatía diabética. Además, hemos constatado que en los dos casos la modificación de la rigidez celular está asociada con alteraciones del citoesqueleto. Una mejor comprensión de los mecanismos moleculares responsables de estas alteraciones permitirá el desarrollo de nuevas terapias cada vez más especializadas.
Palabras clave: Nanotecnología, nanomedicina, cáncer, diabetes, microscopía de fuerza atómica.
Abstract:
Biomedical sciences look towards nanotechnology for new options of treatments and diagnostic tools. Recent technological advances make it possible to study the mechanics of living biological material and its relation to biological or molecular processes.
One of the lines of research developed in our laboratory has as objective to study the effect that different pathologies have in the cellular nanomechanics. In particular, using nanotechnological tools such as the atomic force microscope, we have found that cell stiffness is modified in the case of neuroblastoma or diabetic cardiomyopathy. In addition, we have found that in both cases the modification of cell stiffness is associated with alterations of the cytoskeleton. A better understanding of the molecular mechanisms responsible for these alterations will allow the development of new and increasingly specialized therapies.
Keywords: Nanotechnology, nanomedicine, cancer, diabetes, atomic force microscopy.
Recibido: 24 de julio de 2017
Aceptado: 28 de agosto de 2017.
Introducción
Actualmente, las ciencias biomédicas buscan mejorar el diagnóstico y la terapia de varias enfermedades, por medio de novedosos dispositivos a escala nanométrica. El trabajo llevado a cabo en nuestro laboratorio está orientado al desarrollo de nuevos dispositivos a escala nanométrica para el tratamiento de distintas patologías. Utilizando herramientas nanotecnológicas, estudiamos aspectos fundamentales de los mecanismos por los cuales diferentes patologías como el cáncer o la diabetes afectan la nanomecánica celular. Este es un punto muy importante dado que los datos obtenidos en los últimos años por diferentes laboratorios han mostrado que son varias las patologías que provocan cambios a nivel nanomecánico en las células. A continuación, presentaremos un par de ejemplos de nuestro trabajo referente al uso de la microscopía de fuerza atómica (MFA) para estudiar los cambios en la nanomecánica celular (estudiado a nivel de célula única). Entender los mecanismos físicos, químicos y biológicos por los que una patología afecta un tejido biológico es fundamental para abrir nuevas puertas en la búsqueda de mejoras en tratamientos o herramientas diagnósticas para esas patologías.
Microscopía de fuerza atómica
La microscopía de fuerza atómica se ha constituido como una herramienta fundamental para la investigación en diversas áreas del conocimiento, incluyendo las ciencias biológicas y biomédicas. El MFA permite no sólo reconstruir la topografía de la muestra a dimensiones nanométricas, sino también aplicarle fuerzas controladas a la vez que se mide su deformación. Esto último hace posible caracterizar la muestra en términos de su mecánica, conociendo de forma cuantitativa parámetros como el módulo de Young (relación entre tensión aplicada y deformación causada) y la adhesividad en la superficie.
Al acoplar el MFA con un microscopio óptico de epifluorescencia, que cuente con elementos capaces de controlar la temperatura y la atmósfera en la que se colocará la muestra, se obtiene un instrumento con un gran potencial para el estudio de muestras biológicas en condiciones fisiológicas. De esta forma se pueden estudiar los efectos que diferentes tipos de eventos celulares (como la locomoción, la diferenciación, el envejecimiento, la activación fisiológica, la electromotilidad) o diferentes patologías pudieran tener en la morfología y en propiedades mecánicas, a nivel de célula única.
En la última década se han publicado varios trabajos analizando las propiedades visco-elásticas de diferentes tipos celulares (para revisiones recientes véase Dufrene et al., 2011; Yango et al., 2016; Müller y Dufrêne, 2017.
A continuación, describiremos, en su contexto correspondiente, dos trabajos realizados en nuestro laboratorio donde se aplica esta herramienta.
Neuroblastoma
El neuroblastoma es un tipo de tumor embrionario que puede causar la muerte en niños y se origina en progenitores o células inmaduras del sistema nervioso simpático (Schulte, 2015; Domingo-Fernández et al., 2013).
La lámina A/C es un componente importante de la lámina nuclear que participa en procesos tales como la replicación y transcripción del ADN; su función es soportar el envoltorio nuclear y proveer de sitios de anclaje a la cromatina (Hutchison y Worman, 2004; Takeshi et al., 2016; Worman y Schirmer, 2015; Foisner, 2015; Shimi et al., 2015).
En un trabajo reciente de algunos de los integrantes de nuestro grupo de investigación, observamos por primera vez que la lámina A/C se encuentra silenciada por medio de la hipermetilación aberrante de su promotor en líneas celulares de neuroblastomas (Rauschert et al., 2017). Se observó también que el uso de agentes desmetilantes restituyeron su expresión tanto a nivel de ARN como a nivel proteico.
Las células carentes de lámina A/C demostraron un mayor potencial neoplásico, dado entre otros factores por un mayor potencial de migración e invasión y alteraciones en los diferentes componentes del citoesqueleto. Se comprobó utilizando MFA que las propiedades nanomecánicas se encuentran modificadas en estas células carentes de lámina A/C, resultando en células menos rígidas (menor valor del módulo de Young aparente), con el citoesqueleto alterado, lo que explicaría su tendencia a una mayor capacidad de metástasis (Figura 1).
Figura 1 Histogramas normalizados del módulo de Young aparente (E) obtenido a partir de curvas de fuerza realizadas en células SK-N-SH control (rosado) y células SK-N-SH con la lámina silenciada (azul). Se encontró que E = 1.28 ± 0.37 kPa para el control y E = 0.73 ± 0.30 kPa para las células con lámina silenciada.
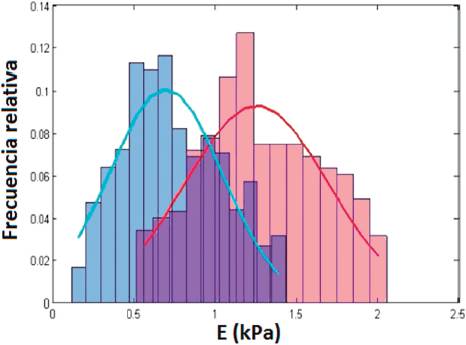
Fuente: Figura extraída de Rauschert et al., 2017, PLoS One.
Estos resultados abren el camino a nuevos estudios de la hipermetilación de promotores de la lámina A/C como un posible biomarcador, en vistas a futuras aplicaciones terapéuticas.
Diabetes
La diabetes mellitus (DM) es una enfermedad crónica y sistémica que afecta actualmente a millones de personas en todo el mundo. Los estudios de proyección de la Federación Internacional de Diabetes estiman que el número de adultos a ser afectados aumentará a 552 millones para el año 2030 (Whiting et al., 2011). La DM es un desorden metabólico caracterizado por hiperglucemia, insulino-deficiencia y/o resistencia a la misma (Boudina y Abel, 2010). La DM está asociada con muchas complicaciones como retinopatía, nefropatía, neuropatía periférica y enfermedad cardiovascular, los cuales son desde el punto de vista pato fisiológico similares tanto en DM tipo 1 (DM1) y DM tipo 2 (DM2) (Waddingham et al., 2015). La enfermedad cardiovascular es la patología asociada más común de la DM, y la principal causa de mortalidad en los pacientes (Candido et al., 2003). En un estudio internacional, el 50 % de los pacientes con diabetes fallecieron por enfermedades cardiovasculares (principalmente enfermedad cardíaca e infarto) (Morrish et al., 2001). La DM1 es resultado de un mecanismo autoinmune y representa aproximadamente 5 al 10 % de los casos de diabetes. Sin embargo, la DM2 representa el 90 al 95 % de los casos de DM y se inicia por la interacción entre genotipo, el ambiente y factores de estilo de vida (Laakso y Kuusisto, 2014).
Diabetes y patologías cardíacas
Las patologías cardíacas asociadas a la DM incluyen cardiomegalia, disfunción del ventrículo izquierdo (VI), remodelamiento eléctrico ventricular, entre otros. Por lo tanto, las complicaciones cardiovasculares, como la arterosclerosis de grandes arterias (carótidas, aorta, y arterias femorales) y la arterosclerosis coronaria, contribuyen al riesgo de infarto de miocardio y paro cardíaco (Boudina y Abel, 2007). Datos clínicos y experimentales sugieren que la diabetes promueve la cardiomiopatía en ausencia de arteriosclerosis coronaria e hipertensión. Los mecanismos patogénicos principales vinculados con esta enfermedad se dividen en: alteraciones metabólicas, fibrosis intersticial, enfermedad microvascular y disfunción autonómica (Arieta, 2011). Así como también, la presencia de hipertrofia del miocardio, falla en las proteínas contráctiles, acumulación de proteínas de la matriz extracelular (fibrosis), alteración de la homeostasis iónica, formación de productos glicosilados y disminución de la función del VI (Battiprolu et al., 2010); (Boudina y Abel, 2010); (Gil-Ortega y Carlos, 2006).
Se ha considerado por mucho tiempo que las disfunciones diastólicas asociadas a la DM son principalmente atribuidas a la fibrosis del VI y la hipertrofia del corazón, causando el aumento de rigidez en el miocardio. Sin embargo, recientes investigaciones proveen evidencia de que la resistencia a la insulina y la hiperglucemia también alteran los procesos intracelulares de los cardiomiocitos, responsables de iniciar y regular la contracción cardíaca (Waddingham et al., 2015).
Fibrosis e hipertrofia
En biopsias de corazones de pacientes diabéticos, se ha encontrado fibrosis intersticial, hipertrofia de miocitos y un aumento en la glicosilación de proteínas contráctiles. Estos factores contribuyen a un menor rendimiento diastólico y a la hipertrofia del VI en estos pacientes. La fracción de eyección (FE) de un corazón es un valor expresado en porcentaje que mide la disminución del volumen del VI en sístole, con respecto a la diástole. Es un parámetro, entonces, que se utiliza para evaluar el porcentaje de sangre expulsada, y, por tanto, el funcionamiento del VI. Van Heerebeek et al., 2008, reportaron que en pacientes diabéticos con una fracción de eyección disminuida, la deposición de productos finales de glicosilación avanzada (advanced glycation end products-AGEs) y la deposición de colágeno son determinantes importantes en una mayor rigidez del VI. Mientras que una mayor tensión en reposo es el principal determinante de una mayor rigidez del VI en pacientes que tienen falla cardíaca con una FE normal.
Los AGEs se forman cuando la glucosa o metabolitos de la glucosa producen modificaciones covalentes estables en proteínas. Estas proteínas modificadas no sólo causan daños directamente, sino que contribuyen a la generación de especies reactivas del oxígeno (ROS) (Wang et al., 2006). Estos, a su vez, causan estrés oxidativo ante la ausencia de defensas antioxidantes suficientes para degradarlos (Murarka y Movahed, 2010). Proteínas extracelulares como el colágeno y la elastina son particularmente vulnerables a la glicosilación. Esto podría disminuir la degradación del colágeno, lo cual contribuye a una acumulación del mismo (fibrosis intersticial). Los crosslinks -productos de la glicosilación no enzimática del colágeno y la elastina en el corazón diabético- junto con la fibrosis resultante, también causan un aumento en la rigidez del miocardio y dificultan la relajación cardíaca, fenómenos típicos en la diabetes (Wang et al., 2006).
Diabetes y nanomecánica del cardiomiocito
Nuestro grupo de investigación viene trabajando con un modelo animal bien caracterizado de diabetes tipo 1. Este modelo se basa en utilizar inyecciones intra-peritoneales de streptozotocina a ratones CD1. La streptozotocina es un antibiótico con propiedades antitumorales y capacidad citotóxica selectiva para las células beta del páncreas. Esta droga es muy utilizada para generar diabetes (insulino-deficientes) en los animales de experimentación. Utilizando este método hemos constatado un mayor índice de mortalidad en los ratones diabéticos que en los controles (Figura 2).
Figura 2 Gráfica de la sobrevida de ratones controles (■) e inyectados con streptozotocina (∆) a lo largo del tiempo.
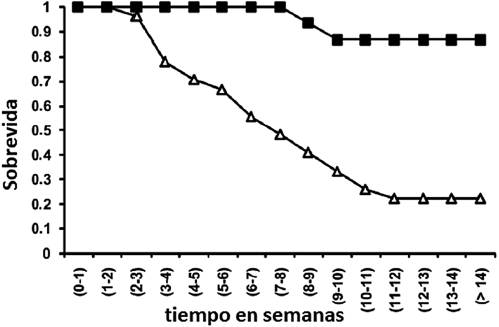
Fuente: Figura extraída de Benech et al., 2014. American Journal of Physiology, Cell Physiology.
Por otra parte, se realizaron imágenes de cortes histológicos obtenidos del miocardio de ratones diabéticos. Las muestras histológicas mostraron células desordenadas, núcleos irregulares, fibras de miocardio fragmentadas, tal como se muestra en la Figura 3.
Figura 3 Cortes histológicos de ventrículo izquierdo de ratón control (A) y con diabetes inducida por estreptzotocina (B). Magnificación 40x.
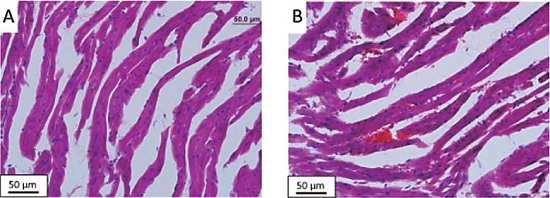
Fuente: Figura extraída de
Se observaron también depósitos de colágeno intersticial, constatando así alteraciones en proteínas de la matriz extracelular. Se detectó por Western Blot la reducción en la expresión de la bomba de Ca+2 y el aumento en la expresión de NCX1 en homogenizados obtenidos del VI de corazones diabéticos, comparado con animales control (Zambrana, 2016). Estos resultados confirman que en nuestro modelo animal de diabetes, la expresión de proteínas del propio cardiomiocito está siendo afectada por la patología. El grupo de investigación es pionero en el estudio de propiedades visco-elásticas, mediante nanoindentación-MFA, en cardiomiocitos aislados provenientes de ratones normales o diabéticos.
Hemos determinado utilizando MFA el módulo elástico aparente (MEA) de cardiomiocitos aislados vivos de ratones diabéticos, cuyo valor medio fue 112% más alto que el de los cardiomiocitos de ratones control (91 ± 14 kPa para diabéticos y 43 ± 7 kPa para cardiomiocitos control). Estos resultados sugieren que las propiedades materiales de cardiomiocitos vivos pueden ser afectadas por la diabetes, resultando en cardiomiocitos más rígidos y contribuyendo muy probablemente a la rigidez diastólica del VI, fenómeno que ya ha sido observado en pacientes diabéticos (Falcão-Pires et al., 2011). Se detectó un reordenamiento de la actina F en cortes de corazón proveniente de los corazones de ratones diabéticos, así como en los cardiomiocitos aislados. En los cardiomiocitos diabéticos, observamos una fuerza de adhesión (interacción entre la punta del tip del MFA y la muestra) 10.5 veces mayor que los grupos control, sugiriendo que el sarcolema del cardiomiocito diabético fue profundamente afectado por la diabetes (Benech et al., 2014, 2015). Al aislarse los cardiomiocitos se pierden la mayoría de los componentes de la matriz extracelular (Lammerding, 2004) por lo que nuestros resultados sugieren que ese cambio -aumento- en el número y/o activación en moléculas de adhesión se encuentra en la superficie del cardiomiocito diabético. Por lo tanto las alteraciones mecánicas del corazón diabético no pueden ser atribuidas solamente a cambios en la composición de la matriz extracelular, sino que también deben atribuirse a cambios significativos de las propiedades nanomecánicas intrínsecas de los propios cardiomiocitos (Benech et al., 2014, 2015; Zambrana, 2016; Bervejillo, 2015; Meininger, 2014).
Actualmente nos encontramos trabajando con la línea celular H9c2. Ésta es una línea celular derivada de corazones de embriones de rata y ha sido usada como modelo in vitro de músculo cardíaco. Esta línea celular retiene varios de los elementos eléctricos y hormonales de los cardiomiocitos y se han constituido en un modelo aceptado para estudiar los efectos de la diabetes en el corazón. De hecho, utilizando esta línea celular observamos que la incubación por 48 hrs en un medio hiperglucémico e hiperlipidémico torna a estas células más rígidas (MEA mayor) que cuando son incubadas en un medio con concentraciones de glucosa y lípidos normal (Alberro, 2016). Utilizando microscopía láser confocal (marcación de actina F con faloidina), el método de nanoindentación por MFA y drogas que desensamblan la actina F (como citocalasina B o D), hemos obtenido resultados que sugieren una correlación entre el aumento de la rigidez de las células en un medio hiperglucémico e hiperlipidémico (MEA mayor) con un reordenamiento de la actina F. Nuestras evidencias sugieren que la actina F es responsable por el 70 % del valor del MEA determinado. Por lo tanto, el reordenamiento espacial de actina F producido por el medio hiperglucémico e hiperlipidémico indica que este fenómeno debería ser estudiado con más profundidad en cardiomiocitos vivos provenientes de ratones diabéticos.
Actualmente estamos estudiando diferentes drogas con la idea de revertir el efecto que la diabetes produce en la nanomecánica del cardiomiocito y en la línea celular H9c2.
Discusión y perspectivas
Utilizando el MFA se logró verificar que las patologías estudiadas alteran la mecánica celular de manera significativa. En el primero de los trabajos presentados, se comprobó que líneas celulares de neuroblastoma con la lámina A / C silenciada tenían una mayor capacidad de metástasis debido a las alteraciones en sus propiedades mecánicas. Una mejor comprensión de estas diferencias puede abrir la puerta a nuevas terapias, como radiaciones de alta frecuencia pero baja intensidad, ya que al tener distintas propiedades mecánicas las células responderían de distinta manera a la misma radiación.
En el segundo trabajo, constatamos que en un modelo in vivo e in vitro, la diabetes produce un aumento en la rigidez celular y un reordenamiento de la actina F. Hoy en día estamos estudiando si diferentes drogas “antidiabéticas” revierten los efectos observados.
Como hemos visto, es de especial importancia comprender los mecanismos por los que distintas patologías modifican la mecánica celular para poder desarrollar nuevas terapias o herramientas de diagnóstico.
Bibliografía
- Alberro, A. (2016). Diabetes mellitus: cambios morfológicos, muerte celular y alteraciones del citoesqueleto de actina inducidos por hiperglucemia e hiperlipidemia en la línea celular H9c2 de mioblastos de embriones de rata. PEDECIBA, tesis de maestría. Universidad de la Republica.
- Arieta, D. R. A. K. (2011). Miocardiopatia diabética. Salud Militar, 1-6.
- Battiprolu, P. K., Gillette, T. G., Wang, Z. V, Lavandero, S., Hill, J. A. (2010). Diabetic cardiomyopathy: Mechanisms and therapeutic targets. Drug Discovery Today. Disease Mechanisms, 7(2), e135-e143. https://doi.org/10.1016/j.ddmec.2010.08.001
- Benech, J. C., Benech, N., Zambrana, A. I., Rauschert, I., Bervejillo, V. y Oddone, N. (2015). Intrinsic nanomechanical changes in live diabetic cardiomyocytes. Cardiovascular Regenerative Medicine, 2(e893), 1-8. https://doi.org/10.14800/crm.893
- Benech, J. C., Benech, N., Zambrana, A. I., Rauschert, I., Bervejillo, V., Oddone, N. y Damián, J. P. (2014). Diabetes increases stiffness of live cardiomyocytes measured by atomic force microscopy nanoindentation. American Journal of Physiology - Cell Physiology, 307(10), C910 LP-C919. Retrieved from http://ajpcell.physiology.org/content/307/10/C910.abstract
- Bervejillo, V. (2015). Glicosilación de proteínas y productos finales de glicosilación avanzada en el corazón diabético. Efectos del Resveratrol. PEDECIBA, tesis de maestría. Universidad de la República, Montevideo, Uruguay.
- Boudina, S. y Abel, E. D. (2007). Diabetic cardiomyopathy revisited. Circulation, 115(25), 3213 LP-3223. Retrieved from http://circ.ahajournals.org/content/115/25/3213.abstract
- Boudina, S. y Abel, E. D. (2010). Diabetic cardiomyopathy, causes and effects. Reviews in Endocrine& Metabolic Disorders, 11(1), 31-39. https://doi.org/10.1007/s11154-010-9131-7
- Candido, R., Forbes, J. M., Thomas, M. C., Thallas, V., Dean, R. G., Burns, W. C., Burrell, L. M. (2003). A breaker of advanced glycation end products attenuates diabetes-induced myocardial structural changes. Circulation Research, 92(7), 785 LP-792. Retrieved from http://circres.ahajournals.org/content/92/7/785.abstract
- Domingo-Fernandez, R., Watters, K., Piskareva, O., Stallings, R. L. y Bray, I. (2013). The role of genetic and epigenetic alterations in neuroblastoma disease pathogenesis. Pediatric Surgery International, 29(2), 101-119. https://doi.org/10.1007/s00383-012-3239-7
- Dufrene, Y. F., Ando, T., Garcia, R., Alsteens, D., Martinez-Martin, D., Engel, A., Muller, D. J. (2011). Imaging modes of atomic force microscopy for application in molecular and cell biology. Nat Nano, 12(4), 295-307. Retrieved from http://dx.doi.org/10.1038/nnano.2017.45
- Falcão-Pires, I., Hamdani, N., Borbély, A., Gavina, C., Schalkwijk, C. G., Van der Velden, J., Paulus, W. J. (2011). Diabetes mellitus worsens diastolic left ventricular dysfunction in aortic stenosis through altered myocardial structure and cardiomyocyte stiffness. Circulation, 124(10), 1151 LP-1159. Retrieved from http://circ.ahajournals.org/content/124/10/1151.abstract
- Foisner, Y. G. y R. (2015). Lamins: Nuclear intermediate filament proteins with fundamental functions in nuclear mechanics and genome regulation. Annual Review of Biochemistry, 84, 131-164.
- Gil-ortega, I. y Carlos, J. (2006). Miocardiopatía diabética, 127(15), 584-594.
- Hutchison, C. J. y Worman, H. J. (2004). A-type lamins: Guardians of the soma? Nat Cell Biol, 6(11), 1062-1067. Retrieved from http://dx.doi.org/10.1038/ncb1104-1062
- Laakso, M. y Kuusisto, J. (2014). Insulin resistance and hyperglycaemia in cardiovascular disease development. Nat Rev Endocrinol, 10(5), 293-302. Retrieved from http://dx.doi.org/10.1038/nrendo.2014.29
- Lammerding, J. (2004). Mechanotransduction in cardiac myocytes. Annals of the New York Academy of Sciences, 1015, 53-70.
- Meininger, G. A. (2014). <em>The central importance of the cytoskeleton for increased cell stiffness in cardiovascular disease</em>. Focus on “Diabetes increases stiffness of live cardiomyocytes MEAsured by atomic force microscopy nanoindentation.” American Journal of Physiology - Cell Physiology, 307(10), C908 LP-C909. Retrieved from http://ajpcell.physiology.org/content/307/10/C908.abstract
- Morrish, N. J., Wang, S.-L., Stevens, L. K., Fuller, J. H. y Keen, H. (2001). Mortality and causes of death in the who multinational study of vascular disease in diabetes. Diabetologia, 44(S2), S14-S21. https://doi.org/10.1007/PL00002934
- Müller, D. J. y Dufrêne, Y. F. (2017). Atomic force microscopy: a nanoscopic window on the cell surface. Trends in Cell Biology, 21(8), 461-469. https://doi.org/10.1016/j.tcb.2011.04.008
- Murarka, S. y Movahed, M. R. (2010). Diabetic cardiomyopathy. Journal of Cardiac Failure, 16(12), 971-979. https://doi.org/10.1016/j.cardfail.2010.07.249
- Rauschert, I., Aldunate, F., Preussner, J., Arocena-Sutz, M., Peraza, V., Looso, M., Agrelo, R. (2017). Promoter hypermethylation as a mechanism for Lamin A/C silencing in a subset of neuroblastoma cells. PLoS ONE (Vol. 12). https://doi.org/10.1371/journal.pone.0175953
- Schulte JH, E. A. (2015). Neuroblastoma. Crit Rev Oncog, 20(3-4), 245 270.
- Shimi, T., Kittisopikul, M., Tran, J., Goldman, A. E., Adam, S. A., Zheng, Y., Goldman, R. D. (2015). Structural organization of nuclear lamins A, C, B1, and B2 revealed by superresolution microscopy. Molecular Biology of the Cell, 26(22), 4075-4086. https://doi.org/10.1091/mbc.E15-07-0461
- Takeshi, S., Pack, C.-G. y Goldman, R. D. (2016). Analyses of the dynamic properties of nuclear lamins by fluorescence recovery after photobleaching (FRAP) and fluorescence correlation spectroscopy (FCS) BT - The nuclear envelope: methods and protocols. In S. Shackleton, P. Collas y E. C. Schirmer (eds.) (pp. 99-111). Nueva York, NY: Springer New York. https://doi.org/10.1007/978-1-4939-3530-7_5
- Van Heerebeek, L., Hamdani, N., Handoko, M. L., Falcao-Pires, I., Musters, R. J., Kupreishvili, K., Paulus, W. J. (2008). Diastolic stiffness of the failing diabetic heart. Circulation, 117(1), 43 LP-51. Retrieved from http://circ.ahajournals.org/content/117/1/43.abstract
- Waddingham, M. T., Edgley, A. J., Tsuchimochi, H., Kelly, D. J., Shirai, M. y Pearson, J. T. (2015). Contractile apparatus dysfunction early in the pathophysiology of diabetic cardiomyopathy. World Journal of Diabetes, 6(7), 943-960. https://doi.org/10.4239/wjd.v6.i7.943
- Wang, J., Song, Y., Wang, Q., Kralik, P. M. y Epstein, P. N. (2006). Causes and characteristics of diabetic cardiomyopathy. The Review of Diabetic Studies, 3(3), 108- 117. https://doi.org/10.1900/RDS.2006.3.108
- Whiting, D. R., Guariguata, L., Weil, C. y Shaw, J. (2011). IDF Diabetes Atlas: Global estimates of the prevalence of diabetes for 2011 and 2030. Diabetes Research and Clinical Practice, 94(3), 311-321. https://doi.org/10.1016/j.diabres.2011.10.029
- Worman, H. J. y Schirmer, E. C. (2015). Nuclear membrane diversity: Underlying tissue-specific pathologies in disease? Current Opinion in Cell Biology, 34, 101-112. https://doi.org/http://dx.doi.org/10.1016/j.ceb.2015.06.003
- Yango, A., Schape, J., Rianna, C., Doschke, H. y Radmacher, M. (2016). Measuring the viscoelastic creep of soft samples by step response AFM. Soft Matter, 12(40), 8297-8306. https://doi.org/10.1039/C6SM00801A
- Zambrana, A. (2016). Efecto del resveratrol en el corazón de ratones diabéticos. PEDECIBA, tesis de maestria. Universidad de la Republica.