Nanopartículas de plata biogénicas a partir del hongo Punctularia atropurpurascens para el control de microrganismos*
Biogenic silver nanoparticles from the fungus Punctularia atropurpurascens for the control of microorganisms
Paula Sanguiñedo,** María Belén Estevez,** Ricardo Faccio,**
Silvana Alborés**1
Abstract:One of the main applications of silver nanoparticles is their antimicrobial activity. The development of drug resistance, as well as the adverse effects that drugs cause, make it necessary to search for alternative strategies for the treatment of these infectious diseases. In the present work, the synthesis of silver nanoparticles by extracts from the fungus Punctularia atropurpurascens was carried out. Different synthesis reaction conditions were studied and the antimicrobial potential of the biogenic nanoparticles was evaluated against microorganisms of interest in health and agriculture areas.
Keywords: nanoparticles, fungi, antimicrobials.
Resumen: Una de las principales aplicaciones de las nanopartículas de plata es su actividad antimicrobiana. La resistencia a drogas, así como los efectos adversos que ocasionan hacen necesaria la búsqueda de estrategias alternativas para el tratamiento de enfermedades infecciosas. En el presente trabajo se realizó la síntesis de nanopartículas de plata por extractos provenientes del hongo Punctularia atropurpurascens. Se estudiaron diferentes condiciones de reacción de síntesis y se evaluó el potencial antimicrobiano de las nanopartículas biogénicas frente a microrganismos de interés en las áreas de salud y agroalimentaria.
Palabras clave: nanopartículas, hongos, antimicrobianos.
Recibido: 19 de octubre de 2018.Aceptado: 23 de noviembre de 2018.
* Los autores agradecen al Instituto de Nanociencia de Aragón de la Universidad de Zaragoza, España, (Dras. Grazú y Fratila) por la imagen de TEM. Este trabajo fue financiado por el Proyecto CSIC I+D 1500-UdelaR, y PEDECIBA Química, Uruguay.
** Universidad de la República, Facultad de Química, Montevideo, Uruguay. Correos electrónicos: paulasd@fq.edu.uy; bestevez@fq.edu.uy; rfaccio@fq.edu.uy
Autora de correspondencia:(salbores@fq.edu.uy)
Introducción
Las nanopartículas de plata poseen propiedades particulares que les atribuyen aplicaciones muy promisorias y novedosas en diversos campos de la ciencia, tales como el desarrollo de biosensores, el diagnóstico y tratamiento de cáncer, la liberación controlada de fármacos, y el potencial antimicrobiano (Sripriya et al., 2013; Boca-Farcau et al., 2014; Liu et al., 2014).
La síntesis biológica de nanopartículas es de gran interés sobre otros métodos (físicos y químicos) porque se evita el uso de químicos tóxicos y condiciones drásticas de reacción. Además, algunas nanopartículas de plata sintetizadas por hongos han presentado amplia actividad antimicrobiana contra bacterias Gram negativas, Gram positivas y hongos patógenos de humanos y plantas (Rodrigues et al., 2013; Sanguiñedo et al., 2018), así como actividad citotóxica contra células cancerosas (Gurunathan et al., 2013).
Para el monitoreo de la biosíntesis el método más utilizado por su simplicidad y sensibilidad es la espectroscopía de absorción UV–visible, mediante la aparición de la banda correspondiente a la resonancia de plasmón de superficie de las nanopartículas de plata (Kora et al., 2010).
Es importante el análisis de las condiciones de reacción que permitan una mayor producción de nanopartículas, así como el control del tamaño y la forma, pues se ha demostrado que condiciones como pH, temperatura, concentración de nitrato de plata, agitación, etc., pueden afectar las características de las nanopartículas sintetizadas (Korbekandi et al., 2013). Para la caracterización de las nanopartículas biosintetizadas además de la espectroscopía UV–visible, se utilizan diversas técnicas como difracción de rayos X y microscopía electrónica de transmisión (TEM) que permiten caracterizar tamaño, forma y distribución.
Una de las principales aplicaciones de las nanopartículas de plata es su actividad antimicrobiana. Las enfermedades infecciosas son aún una de las principales causas de muerte en el mundo. El desarrollo de resistencia a drogas, así como los efectos adversos que ocasionan hacen necesaria la búsqueda de estrategias alternativas para el tratamiento de dichas enfermedades (OMS, 2014). En el área agrícola, a pesar de las mejoras en la capacidad de diagnóstico y disponibilidad de tecnologías para el control de enfermedades, ellas aún son capaces de causar enormes pérdidas de cosechas (Vurro et al., 2010). El potencial antimicrobiano de las nanopartículas de plata es muy promisorio; se ha demostrado su efectividad para el tratamiento de enfermedades infecciosas, frente a bacterias resistentes a antibióticos, en estudios in vitro y en modelos animales (Hajipour et al., 2012; Shanthi et al., 2016), en la conservación de alimentos (Becaro et al., 2016) y en el control de fitopatógenos (Jo et al., 2015; Elgorban et al., 2016).
En el presente trabajo se realizó la síntesis de nanopartículas de plata por extractos provenientes del hongo Punctularia atropurpurascens. Se estudiaron diferentes condiciones de reacción de síntesis y se evaluó el potencial antimicrobiano de las nanopartículas biogénicas frente a microrganismos de interés en las áreas de salud y agroalimentaria.
Materiales y métodos
Material biológico
Se utilizó la cepa fúngica Punctularia atropurpurascens H2126, perteneciente a la Colección de Cepas de la Cátedra de Microbiología de la Facultad de Química, proveniente de un aislamiento a partir de muestras de madera colectadas en Uruguay. Para los ensayos de actividad antimicrobiana se utilizaron las cepas de colección Staphyloccocus aureus ATCC6538P, Escherichia coli ATCC 25922, y Candida albicans ATCC 101231.
Cultivo del hongo y obtención de micelio
Primeramente se realizó un cultivo del hongo en medio sólido Potato Dextrosa Agar (PDA, BD Difco). Se extrajeron discos de micelio de dicho cultivo y se inocularon dos discos en 100 mL de medio líquido Potato Dextrose Broth (PDB, BD Difco). Se incubó a 28 ºC, con agitación constante (150 rpm) en un periodo adecuado para obtener suficiente biomasa para continuar con los ensayos. Finalizado el periodo de incubación en medio líquido, se separó el micelio del medio de cultivo por filtración con papel estéril. El micelio retenido en el filtro se lavó con agua destilada estéril y se secó con toallas de papel estériles. Se determinó el peso húmedo del micelio obtenido.
Biosíntesis de nanopartículas
El ensayo de biosíntesis de nanopartículas (NPs) se realizó con base en el realizado por Rodrigues et al. (2013) con algunas modificaciones. El micelio se incubó en agua destilada estéril (0.1 g/mL) durante 72 horas, con agitación constante (150 rpm) a 28 °C. Luego de la incubación, se separó el micelio del caldo extracelular mediante filtración por membrana 0.22 μM (Millipore). El extracto extracelular filtrado se dividió en dos fracciones, una oficiando como control mientras que a la otra fracción se le agregó igual volumen de solución estéril de AgNO3. Las dos fracciones se incubaron a temperatura ambiente en oscuridad. Se realizó el seguimiento de la biosíntesis mediante realización de espectros de absorción (incluyendo el control) entre 250 y 800 nm, en un espectrofotómetro UV–visible (Jenway 6715), y midiendo el incremento de absorción en el pico de longitud de onda máximo, correspondiente a la resonancia de plasmón de superficie de las NPs sintetizadas, a lo largo del tiempo.
Evaluación de condiciones de reacción de biosíntesis
Para evaluar la incidencia de las variables de la reacción en la biosíntesis de las NPs se estudiaron individualmente las siguientes condiciones experimentales: tiempo de incubación del micelio en agua (24, 48 y 72 horas), temperatura (28 °C y 37 °C) y concentración de AgNO3 en la reacción de síntesis (1 y 5 μM). Cada variable fue evaluada por duplicado, midiendo la absorbancia a λ = 440 nm en función del tiempo. Además, se realizó análisis de varianza (ANOVA) en el tiempo final de la síntesis para determinar si existían diferencias significativas en las distintas condiciones evaluadas (p < 0.05).
Purificación de las NPs
Las NPs sintetizadas fueron centrifugadas (centrífuga refrigerada SORVALL–Thermo Scientific), lavadas y resuspendidas en agua destilada estéril, obteniendo así la solución de NPs a utilizar en los siguientes ensayos. Se realizó el espectro de absorción, se midió la banda de absorbancia correspondiente a las NPs purificadas y se estimó su concentración según lo descrito por Paramelle et al. (2014).
Caracterización de las NPs sintetizadas
Para la caracterización de las NPs biosintetizadas, además de la espectroscopía UV–visible se utilizaron otras metodologías. Mediante microscopía electrónica de transmisión (TEM) y difracción de rayos X a bajos ángulos (SAXS) se determinó el tamaño, distribución y morfología de las NPs.
TEM
Se depositaron 10 μL de la solución de NPs en una rejilla de cobre recubierta de carbono (Electron Microscopy Sciences). Se dejó secar la muestra a temperatura ambiente. El análisis se llevó a cabo en el microscopio electrónico TECNAI T20 (FEI) a 200 kV. El procesamiento de las imágenes fue realizado con el software Image J.
SAXS
Se utilizó un difractómetro de polvo Rigaku, model Ultima IV, utilizando radiación generada por un ánodo de Cu con CuKalpha = 1.5418 Å. Las medidas se hicieron a bajo ángulo, en geometría Bragg–Brentano, con un offset de 0.2 Å sobre depósitos de NPs sobre sustrato de silicio. El rango de medida de q = 0.05 Å-1 a 1.50 Å-1.
Evaluación de actividad antimicrobiana in vitro.
Determinación de concentración inhibitoria mínima (CIM)
Se determinó mediante la técnica de dilución descrita por el Clinical and Laboratory Standards Institute (CLSI 2012), en microplacas de titulación de fondo plano (NUNC–Thermo Scientific). Se sembraron suspensiones de los microrganismos en caldo Mueller–Hinton (Himedia) con diluciones seriadas de la solución de NPs. Como controles se sembraron el caldo de cultivo, suero fisiológico (igual volumen que la solución de NPs) con y sin la suspensión del microrganismo. Luego de la incubación a temperatura y tiempo adecuados para cada microrganismo se determinó la mínima concentración que causó inhibición visible del crecimiento microbiano. Además, se incluyeron como controles positivos algunos antimicrobianos (antibióticos, solución de nitrato de plata).
Resultados
Biosíntesis de NPs de plata
Durante el seguimiento de la reacción de síntesis, se constató un aumento de la absorbancia en la región 420-460 nm, el cual se corresponde con la resonancia de plasmón de superficie (RPS). Asimismo, se observó un notorio cambio de color en el medio de reacción de las NPs, no así con la fracción empleada como control (figura 1).

Figura 1. Color observado: (a) al iniciar la reacción (0 horas), y, (b) luego de 72 horas de reacción; a la izquierda el control y a la derecha la síntesis de NPs.
Fuente: Elaboración de los autores.
Evaluación de la incidencia de condiciones de reacción
en la biosíntesis de NPs
En el estudio de la incidencia del cambio de variables en la reacción de biosíntesis, se observó que la misma era más favorable al incubar el micelio en agua destilada durante 24 horas (figura 2a). Asimismo, se obtuvieron resultados correspondientes a una mayor síntesis de NPs cuando la temperatura de reacción fue de 37 °C (figura 2b) y también cuando se empleó AgNO3 5mM (figura 2c). Además, el análisis de varianza a tiempo final de reacción mostró que existían diferencias significativas en la absorbancia a 440 nm (p < 0.05) para las distintas condiciones evaluadas.
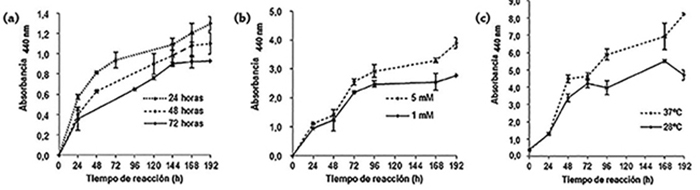
Figura 2. Efecto de diferentes condiciones de reacción en la síntesis de NPs (medida por absorbancia a 440 nm) en el tiempo (las barras indican la desviación estándar): (a) distintos tiempos de incubación, (b) distintas concentraciones de nitrato de plata, (c) distintas temperaturas.
Fuente: Elaboración de los autores.
Purificación de NPs de plata
Las muestras fueron centrifugadas y las NPs en el pellet fueron lavadas para obtener las NPs aisladas. Para estudiar la estabilidad coloidal de las NPs purificadas se utilizó espectroscopía UV–vis. Después de la centrifugación y resuspensión las NPs presentaron una alta banda de absorción por encima de 400 nm correspondiente a la RPS de las NPs de plata (figura 3). Esto demuestra que en estas condiciones de centrifugación las NPs pudieron separarse sin perder estabilidad coloidal (no agregaron).
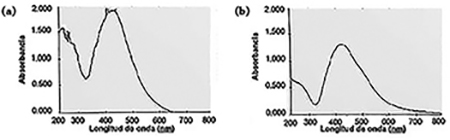
Figura 3. Espectros de absorción UV–vis de las NPs antes (a) y después (b) de la centrifugación.
Fuente: Elaboración de los autores.
Caracterización de las NPs
Luego de seleccionadas las condiciones de síntesis se realizó la caracterización de las NPs. El análisis de las micrografías de TEM usando el software Image J mostró que eran de forma esférica con un tamaño promedio de 11(2) nm (figura 4). Además, estudios de SAXS mostraron dos picos asociados con poblaciones de NPs esféricas. Las distancias características obtenidas del ajuste corresponden a 17(3) nm y 46(1) nm (figura 5). La primera población podría atribuirse al tamaño de las NPs, mientras que la segunda podría corresponder a una segunda población pero de mayor tamaño, resultado del proceso de secado necesario para realizar el prepar

Figura 4. Micrografía de TEM de las NPs.
Fuente: Fuente: Dras. Grazú y Fratila del Instituto de Nanociencia de Aragón de la Universidad de Zaragoza, España.
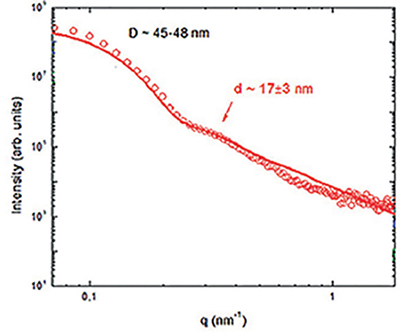
Figura 5. SAXS para un preparado de NPs depositada sobre placa de silicio. Se evidencian dos distancias de correlación en 45-48 y 17nm.
Fuente: Elaboración de los autores.
Actividad antimicrobiana. Determinación de la CIM
Para evaluar su potencial aplicación como antimicrobiano se realizó la determinación cuantitativa de dicha actividad (CIM) frente a los siguientes microrganismos: C. albicans, S. aureus y E. coli. Los resultados se presentan en la tabla 1. Los controles positivos utilizados en los ensayos (antibióticos y solución de AgNO3) presentaron valores de CIM superiores (en el orden de µM y ηM).
| C. albicans | E. coli | S. aureus | 2.1 pM | 2.1 pM | 8.5 p M |
|---|
Fuente: Elaboración de los autores.
Discusión
En este trabajo se avanzó en estudios de incidencia de condiciones de reacción, caracterización y de aplicaciones como antimicrobianos de las NPs sintetizadas utilizando el hongo P. atropurpurascens. Con el objetivo de producir NPs estables, con un mayor rendimiento en tiempos de reacción más cortos para su potencial uso en diversas aplicaciones biotecnológicas, se evaluó la incidencia de las condiciones de reacción para la biosíntesis de NPs. Dentro de los resultados obtenidos vale la pena destacar el tiempo, el cual fue menor que en el protocolo utilizado en estudios previos (Sanguiñedo et al., 2018), lo que representa una ventaja teniendo en cuenta ensayos futuros a mayor escala. Se separaron las NPs por centrifugación y se confirmó su estabilidad; esta estrategia permite la purificación de las NPs, un paso muy importante para las diferentes aplicaciones. Esta estabilidad luego de la centrifugación es indicativo de la formación de una capa orgánica fuertemente unida al core inorgánico de la nanopartícula metálica. Las NPs sintetizadas se mantuvieron estables luego de dicho proceso, manteniendo la banda correspondiente a la resonancia de plasmón de superficie en el espectro de absorción de la solución de NPs; las propiedades plasmónicas de las NPs de plata proveen un método sencillo para este monitoreo: la agregación de las mismas generaría una disminución de la intensidad en el pico de resonancia de plasmón de superficie así como un corrimiento en el espectro visible hacia el infrarrojo (Sivera et al., 2014; Sharma et al., 2016).
Los estudios de caracterización por TEM y SAXS permitieron determinar la forma, el tamaño y disposición de las NPs.
Dentro de las muy diversas aplicaciones de las NPs de plata en este trabajo se abordó su aplicación como agente antimicrobiano. Los resultados de actividad antibacteriana fueron similares a los obtenidos previamente con nanopartículas biogénicas frente a diferentes especies bacterianas (Quinteros et al., 2016). Asimismo, las CIM de las NPs frente a las bacterias utilizadas en este trabajo fueron al menos tres órdenes menores que las obtenidas para los antibióticos gentamicina, cloranfenicol y ciprofloxacina, así como la solución de nitrato de plata, utilizadas como control.
Todos estos resultados obtenidos en los ensayos de actividad antimicrobiana in vitro fueron muy promisorios, demostrando el gran potencial antimicrobiano de las NPs tanto frente a bacterias (Gram positivas y Gram negativas) como a hongos, de interés en el área de salud o agroalimentaria.
Referencias
Becaro AA, Puti FC, Panosso AR, Gern JC, Brandão HM, Correa DS y Ferreira MD (2016). Postharvest quality of fresh-cut carrots packaged in plastic films containing silver nanoparticles. Food and Bioprocess Technology, 637-649. https://doi.org/10.1007/s11947-015-1656-z
Boca–Farcau S, Potara M, Simon T, Juhem A, Baldeck P y Astilean S (2014). Folic acid-conjugated, SERS-labeled silver nanotriangles for multimodal detection and targeted photothermal treatment on human ovarian cancer cells. Molecular Pharmaceutics, 11: 391-399. https://doi.org/10.1021/mp400300m
Clinical and Laboratory Standards Institute (CLSI) (2012). Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically, approved standard, 10a ed.
Elgorban AM, El-Samawaty AERM, Yassin MA et al. (2016). Antifungal silver nanoparticles: Synthesis, characterization and biological evaluation. Biotechnology and Biotechnological Equipment, 30: 56-62.
https://doi.org/10.1080/13102818.2015.1106339
Gurunathan S, Raman J, Abd Malek SN, John PA y Vikineswary S (2013). Green synthesis of silver nanoparticles using Ganoderma neo-japonicum Imazeki: A potential cytotoxic agent against breast cancer cells. International Journal of Nanomedicine, 8: 4399-4413. https://doi.org/10.2147/IJN.S51881
Hajipour MJ, Fromm KM, Akbar Ashkarran A et al. (2012). Antibacterial properties of nanoparticles. Trends in Biotechnology, 30: 499-511.
https://doi.org/10.1016/j.tibtech.2012.06.004
Jo Y-K, Cromwell W, Jeong H-K, Thorkelson J, Roh J-H y Shin D-B (2015). Use of silver nanoparticles for managing Gibberella fujikuroi on rice seedlings. Crop Protection, 74: 65-69. https://doi.org/10.1016/j.cropro.2015.04.003
Kora AJ, Sashidhar RB y Arunachalam J (2010). Gum kondagogu (Cochlospermum gossypium): A template for the green synthesis and stabilization of silver nanoparticles with antibacterial application. Carbohydrate Polymers, 82: 670-679. https://doi.org/10.1016/j.carbpol.2010.05.034
Korbekandi H, Ashari Z, Iravani S y Abbasi S (2013). Optimization of biological synthesis of silver nanoparticles using Fusarium oxysporum. Iranian Journal of Pharmaceutical Research, 12: 289-298.
Liu Y, Wang G, Li C, Zhou Q, Wang M y Yang L (2014). A novel acetylcholinesterase biosensor based on carboxylic graphene coated with silver nanoparticles for pesticide detection. Materials Science and Engineering C, 35: 253-258. https://doi.org/10.1016/j.msec.2013.10.036
OMS (2014). Estadísticas Sanitarias Mundiales 2014: Una mina de información sobre salud pública mundial. http://www.who.int/gho/publications/world_health_statistics/2014/es/
Paramelle D, Sadovoy A, Gorelik S, Free P, Hobley J y Fernig DG (2014). A rapid method to estimate the concentration of citrate capped silver nanoparticles from UV–visible light spectra. Analyst, 139: 4855-4861.
https://doi.org/10.1039/C4AN00978A
Quinteros M, Aiassa I, Dalmasso P, Paez P (2016). Silver nanoparticles: Biosynthesis using an ATCC reference strain of Pseudomonas aeruginosa and activity as broad spectrum clinical antibacterial agents. International Journal of Biomaterials, 5: 1-7. http://dx.doi.org/10.1155/2016/5971047
Rodrigues AG, Ping LY, Marcato PD et al. (2013). Biogenic antimicrobial silver nanoparticles produced by fungi. Applied Microbiology and Biotechnology, 97: 775-782. http://dx.doi.org/10.1007/s00253-012-4209-7
Sanguiñedo P, Fratila RM, Estevez MB, de la Fuente JM, Grazú V y Alborés S (2018). Extracellular biosynthesis of silver nanoparticles using fungi and their antibacterial activity. Nano Biomedicine and Engineering, 10: 165-173.
http://dx.doi.org/10.5101/nbe.v10i2.p165-173
Shanthi S, David Jayaseelan B, Velusamy P, Vijayakumar S, Chih CT y Vaseeharan B (2016). Biosynthesis of silver nanoparticles using a probiotic Bacillus licheniformis Dahb1 and their antibiofilm activity and toxicity effects in Ceriodaphnia cornuta. Microbial Pathogenesis, 93: 70-77.
http://dx.doi.org/10.1016/j.micpath.2016.01.014
Sharma M, Mishra A, Kumar V y Basu S (2016). Green synthesis of silver nanoparticles with exceptional colloidal stability and its catalytic activity toward nitrophenol reduction. Nano, 11: 1650046.
https://doi.org/10.1142/S1793292016500466
Sivera M, Kvitek L, Soukupova J, Panacek A, Prucek R, Vecerova R y Zboril R (2014). Silver nanoparticles modified by gelatin with extraordinary pH stability and long-term antibacterial activity. PLoS ONE, 9(8): e103675.
http://dx.doi.org/10.1371/journal.pone.0103675
Sripriya J, Anandhakumar S, Achiraman S, Antony JJ, Siva D y Raichur AM (2013). Laser receptive polyelectrolyte thin films doped with biosynthesized silver nanoparticles for antibacterial coatings and drug delivery applications. International Journal of Pharmaceutics, 457: 206-213.
http://dx.doi.org/10.1016/j.ijpharm.2013.09.036
Vurro M, Bonciani B y Vannacci G (2010). Emerging infectious diseases of crop plants in developing countries: Impact on agriculture and socio-economic consequences. Food Security, 2: 113-132.
http://dx.doi.org/10.1007/s12571-010-0062-7