www.mundonano.unam.mx | Mundo Nano
http://dx.doi.org/10.22201/ceiich.24485691e.2022.28.69682 | 15(28), 1e-25e, enero–junio 2022
Artículos de revisión
Gobernanza de la nanomedicina: una revisión sistemática
Nanomedicine governance: a systematic review
Roberto Soto-Vazquez*♦
Edgar Záyago Lau**
Luis Alfonso Maldonado López***
* Centro de Investigación y de Estudios Avanzados (CINVESTAV) del Instituto Politécnico Nacional (IPN)-Unidad Zacatenco. México.
** Universidad Autónoma de Zacatecas-Unidad Académica en Estudios del Desarrollo. México.
*** Centro de Investigación y de Estudios Avanzados (CINVESTAV) del Instituto Politécnico Nacional (IPN)-Unidad Mérida. México.
♦ Autor de correspondencia: roberto.soto@cinvestav.mx
Resumen:
La nanomedicina (la aplicación de la nanotecnología en medicina) está revolucionando el diagnóstico, tratamiento y control de enfermedades. Aunque es cierto que esta ha generado importantes beneficios desde el punto de vista médico, existen riesgos toxicológicos, ambientales, éticos y sociales que deben ser analizados. La gobernanza, entre otras cosas, abarca la gestión de riesgos y beneficios de las nuevas tecnologías, por lo que puede aplicarse en nanomedicina para el análisis de riesgos. El objetivo de este artículo es mostrar un panorama de la gobernanza de la nanomedicina a través de una revisión sistemática de la literatura científica. La metodología empleada consistió en los siguientes pasos: 1) búsqueda de artículos en las bases de datos de Scopus, Web of Science y SciELO; 2) limpieza de resultados; 3) obtención de datos altmétricos de la plataforma Dimensions; 4) descarga y lectura de los artículos, y, 5) análisis crítico de los artículos. Como resultado se identificaron deficiencias regulatorias y preocupaciones éticas vinculadas con los productos nanomédicos, pero también se encontraron propuestas para evaluar riesgos y abordar aspectos éticos. Se concluye que, aunque ha habido progresos en la evaluación de riesgos, aún existen asuntos pendientes en materia de regulación.
Palabras clave: nanomedicina, gobernanza, regulación, riesgos, aspectos éticos.
Abstract:
Nanomedicine bears essential benefits from both medical and technical perspectives. However, there are toxicological, environmental, ethical, and social implications worth researching. Governance encompasses, among other things, the management of risks and benefits of new technologies to minimize risk and, presumably, increasing benefits. This paper aims to show an overview of nanomedicine governance through a systematic review of scientific literature. The methodology consisted of five steps: 1) searching for papers in Scopus, Web of Science and SciELO; 2) cleaning results; 3) gathering altmetrics from Dimensions; 4) reviewing papers, and, 5) critical analysis of the papers. We identified certain regulatory deficiencies and ethical issues related to nanomedical products. There has been an advance in researching threats to health and the environment from nanomedical applications, but there are still gaps in regulation.
Keywords: nanomedicine, governance, regulation, risks, ethical issues.
Recibido: 1 de junio, 2021.
Aceptado: 9 de agosto, 2021.
Introducción
Desde hace dos décadas, la nanotecnología se ha involucrado en el sector médico para propiciar mejoras en el diagnóstico, monitoreo, control, prevención y tratamiento de enfermedades a través del uso de nanomateriales. Esta vinculación entre nanotecnología y medicina ha dado lugar al surgimiento de un nuevo campo disciplinario denominado nanomedicina. Las áreas del sector médico donde la nanomedicina ha tenido mayor repercusión son la administración de fármacos, la terapia, el diagnóstico y los biomateriales.
En la administración de fármacos se han empleado nanoestructuras como liposomas, dendrímeros, fulerenos y nanopartículas poliméricas para transportar medicamentos a partes específicas del cuerpo humano. El uso de estos nanotransportadores ofrece importantes ventajas con respecto a los métodos convencionales de administración de fármacos. Debido a su tamaño, los nanotransportadores pueden atravesar barreras biológicas y fisiológicas que normalmente son impermeables para estructuras más grandes, lo cual redunda en una mayor eficacia en la entrega de los fármacos (Rana y Sharma, 2019). Otra ventaja es que, mediante la manipulación de sus propiedades superficiales, los nanotransportadores pueden ser dirigidos específicamente a los órganos y tejidos enfermos; de esta manera, se reducen los efectos secundarios debidos a la propagación de los fármacos en tejidos sanos. Estas ventajas se han aprovechado en el desarrollo de nuevos tratamientos contra el cáncer donde se utilizan nanotransportadores para enviar los fármacos directamente a los tumores cancerosos (Meel R. van der et al., 2019). Si bien es cierto que la administración de fármacos mediada por nanotransportadores se ha enfocado principalmente en el desarrollo de tratamientos contra el cáncer, también existe potencial para aplicar esta tecnología en el tratamiento de enfermedades cardiovasculares, diabetes tipo 1, infecciones fúngicas, linfomas o leucemias, así como enfermedades que afectan partes del cuerpo poco accesibles como el cerebro y los ojos (Caracciolo, 2015). Los nanotransportadores más empleados en la administración de fármacos son los liposomas, y actualmente existen en el mercado varios fármacos liposomales como, por ejemplo: Doxil®, Myocet®, DaunoXom®, Onivyde®, Marqibo®, entre muchos otros (Gadekar et al., 2021).
La nanomedicina también ha incidido en la mejora y en el desarrollo de nuevas terapias médicas tales como la hipertermia magnética y la terapia fotodinámica. La hipertermia magnética es una terapia contra el cáncer que se basa en la capacidad de las nanopartículas magnéticas para generar calor cuando se exponen a un campo magnético (Lemine, 2019). En este tipo de terapia, al paciente se le administran nanopartículas magnéticas que se dirigen específicamente al tumor canceroso. Una vez que las nanopartículas llegan al tumor, se aplica un campo magnético para provocar el movimiento de las nanopartículas dentro del tumor. El calor que se produce por este movimiento altera la fisiología de las células enfermas e induce su apoptosis (muerte celular). Por otra parte, la terapia fotodinámica también provoca la apoptosis de las células enfermas, pero lo hace a través de sustancias fotosensibilizadoras que se activan con la irradiación de luz. En este tipo de terapia, la nanomedicina ha contribuido con el desarrollo de nanotransportadores para dirigir las sustancias fotosensibilizadoras a las células enfermas (Kim, Jo y Na, 2020).
Otra área donde la nanomedicina ha hecho importantes contribuciones es el diagnóstico de enfermedades, principalmente en la optimización de técnicas de imagenología y en el desarrollo de biosensores para diagnósticos in vitro. La imagenología es una técnica de diagnóstico consistente en la observación directa de los órganos y tejidos del paciente, a través de distintas técnicas de obtención de imágenes tales como rayos X, tomografías computarizadas y resonancia magnética. En este rubro, la nanomedicina ha introducido el uso de nanopartículas como agentes de contraste para mejorar la resolución de las imágenes (Li et al., 2016). Lo anterior es muy importante por posibilitar la detección de tumores y otras enfermedades en etapas muy tempranas. Por otra parte, los diagnósticos in vitro consisten en la extracción de muestras del paciente, ya sean de fluidos corporales o de algún tejido, para su posterior análisis en laboratorio. La utilización de biosensores nanoestructurados en el análisis de las muestras de los pacientes tiene importantes ventajas: se requieren muestras más pequeñas, se logra una mayor selectividad de los compuestos de interés y los diagnósticos son más rápidos. Un ejemplo reciente de innovación en este tema es el diseño de nanobiosensores para la detección del virus SARS-CoV-2 (Funari, Chu y Shen, 2020; Qiu et al., 2020).
En lo que respecta al área de biomateriales, la nanomedicina ha contribuido en el desarrollo de recubrimientos a base de nanopartículas que se aplican en los implantes médicos para mejorar su biocompatibilidad y prolongar su vida útil (Basova et al., 2021). Asimismo, existen nanomateriales con propiedades bactericidas y antivirales utilizadas en la manufactura de productos médicos. El ejemplo más emblemático de esto son las nanopartículas de plata, cuyas propiedades bactericidas se han aprovechado en la fabricación de apósitos para heridas, dispositivos anticonceptivos, instrumentos quirúrgicos e implantes ortopédicos (Chen y Schluesener, 2008). Otro nanomaterial que recientemente ha llamado la atención por sus propiedades antivirales son las nanopartículas de cobre, las cuales podrían utilizarse en el desarrollo de equipos de protección personal frente al virus SARS-CoV-2 (Sportelli et al., 2020).
Lo precedente ilustra a grandes rasgos las posibilidades de los beneficios de la nanomedicina; sin embargo, existen desafíos importantes en cuanto a la seguridad, regulación y aspectos éticos que debemos considerar. Aún no se conocen con total certeza los posibles efectos toxicológicos de los productos nanomédicos en el ser humano (Khare, Saxena y Gupta, 2015). Tampoco se cuenta con regulaciones adecuadas para normar la fabricación, control de calidad, seguridad y evaluación de la eficacia de estos productos (Zhang et al., 2020). Además, existen preocupaciones éticas relacionadas con la gestión de los riesgos toxicológicos, equidad en el acceso a los productos nanomédicos, protección de la información médica de los pacientes y transhumanismo (mejoramiento de las capacidades físicas e intelectuales de los humanos mediante el uso de la tecnología) (Graur et al., 2011; Bawa y Johnson, 2020).
En diversos espacios se avanza en la gobernanza como un mecanismo de orden normativo que pudiera coadyuvar a direccionar la trayectoria de ciertas tecnologías y sus desafíos. La Organización para la Cooperación y el Desarrollo Económicos (OCDE) define la gobernanza tecnológica como el proceso de ejercer la autoridad política, económica y administrativa en el desarrollo, difusión y funcionamiento de la tecnología en las sociedades (OCDE, S. f.). El propósito de la gobernanza es gestionar los riesgos y beneficios de la tecnología, es decir, aprovechar sus bondades, al mismo tiempo de prevenir o mitigar sus posibles efectos negativos. En este proceso, idealmente, no solo participan agentes gubernamentales, sino que también colaboran empresarios, científicos y representantes de la sociedad civil. Al mismo tiempo, es en este espacio en el que interactúan fuerzas de distintos niveles, ya sean locales, nacionales, regionales o de corte internacional. La gobernanza como instrumento de política pública, que se explicita en la norma y el orden jurídico, permite la participación y el fortalecimiento de los esquemas de protección social con el objetivo de equilibrar los distintos poderes e intereses de los agentes o participantes que interactúan (Pierre y Peters, 2000). La integración de las economías a nivel mundial, vis à vis la globalización, implica dificultades y retos para la mediación de los derechos en el espacio nacional, la participación de la autoridad y los derechos de los actores sociales, políticos y económicos; lo cual genera configuraciones “desnacionalizadas” que operan en el espacio subnacional, nacional o global (Sassen, 2013: 507). En este orden de ideas, Ocampo (2015) discute que la gobernanza, como marco institucional para la interacción de actores o grupos intergubernamentales, es conductora y reproductora de tres fenómenos diferenciadores: i) la concentración en pocos países del progreso tecnológico y productivo; ii) acumulación de recursos financieros (por la configuración del sistema monetario), y, iii) la movilidad y la conquista de factores de producción (Ocampo, 2015: 36). La gobernanza es, pues, un instrumento coadyuvante en la socialización del beneficio tecnológico y la disminución de los riesgos o aspectos no deseados.
En términos de la regulación de las tecnologías, la gobernanza se manifiesta a partir de las declaraciones y pronunciamientos que influyen en la discusión y la reglamentación; esto incluye desde luego a la nanotecnología (Foladori, 2009).
El enfoque de gobernanza se ha utilizado para analizar algunos aspectos de la nanotecnología, tales como la evaluación y gestión de riesgos (Renn y Roco, 2006), la regulación (Foladori, 2009; Saldivar-Tanaka, 2019), y el financiamiento a las actividades de investigación e innovación (Anzaldo, Chauvet y Maldonado, 2014). Si bien es cierto que la gobernanza de la nanotecnología abarca algunos puntos aplicables a la nanomedicina, esta última tiene sus propios desafíos de gobernanza que merecen un estudio aparte. A diferencia de otras áreas, la nanomedicina implica la exposición humana intencional a los nanomateriales, lo cual plantea desafíos específicos para este campo (Bhatia y Chugh, 2017).
A nivel internacional se han hecho algunos esfuerzos en materia de gobernanza para enfrentar los desafíos éticos, regulatorios y de riesgos que plantean la nanotecnología y la nanomedicina. En 2012, se celebró una reunión de expertos de la Organización Mundial de la Salud (WHO, por sus siglas en inglés) sobre el tema de nanotecnología y salud humana, y la discusión se centró en cuatro áreas: a) evaluación de la exposición de nanomateriales; b) nanotoxicología; c) evaluación de riesgos, y, d) regulación y gobernanza de riesgos (WHO, 2013). En este mismo sentido, la OCDE y Grupo Allianz (S. f.) han señalado la necesidad de incrementar el financiamiento a la investigación de riesgos de los nanomateriales. Por otra parte, la Comisión Europea ha establecido grupos de trabajo que han hecho contribuciones a la gobernanza de la nanomedicina; por ejemplo, el Comité Científico de los Riesgos Sanitarios Emergentes y Recientemente Identificados (SCENIHR, por sus siglas en inglés) elaboró una guía para evaluar los riesgos de los nanomateriales utilizados en dispositivos médicos (SCENIHR, 2015), y el Grupo Europeo de Ética de la Ciencia y las Nuevas Tecnologías (EGE, por sus siglas en inglés) emitió un documento de opinión sobre las preocupaciones éticas derivadas de la nanomedicina (EGE, 2007). Otra iniciativa emanada de la Comisión Europea es el EU NanoSafety Cluster, cuyo propósito es maximizar la sinergia entre los proyectos de investigación que se llevan a cabo en Europa en torno a la seguridad de los nanomateriales (EU NanoSafety Cluster, S. f.).
El objetivo de este artículo es destacar la relevancia de la gobernanza de la nanomedicina mediante una revisión sistemática de los artículos publicados sobre el tema a nivel internacional.
Metodología
La búsqueda de los artículos para la revisión de la literatura se realizó en tres bases de datos: Web of Science (WoS), Scopus y SciELO. Se eligieron WoS y Scopus por ser las bases de datos bibliográficas más relevantes a nivel mundial (Zhu y Liu, 2020); no obstante, su contenido está principalmente en inglés. Para abarcar publicaciones en otros idiomas como español y portugués, se incluyó en la estrategia de búsqueda la base de datos SciELO, al enfocarse esta en la producción científica de América Latina, el Caribe, España y Portugal.
Para determinar los términos clave a utilizar, primero se llevó a cabo una búsqueda preliminar con los términos governance y nanomedicine. Se encontró que las publicaciones sobre gobernanza de la nanomedicina abordan temas de regulación, riesgos y ética; por lo tanto, se añadieron los términos risks, regulation y ethics. Después se agregaron los términos nanotechnology, medicine y medical, con el propósito de abarcar otras denominaciones con las que se identifica la nanomedicina, como lo son, por ejemplo: nanotechnology in medicine; nanotechnology in medical applications; nanotechnology for medical purposes, entre otros. Todos estos términos se enlazaron por medio de operadores booleanos para construir cadenas de búsqueda, las cuales se muestran en la Tabla 1. En las tres bases de datos se realizaron búsquedas en modo avanzado. En WoS y Scopus se especificaron los siguientes parámetros: a) tipo de documento: artículo; b) idioma: todos; c) periodo: todos los años. En SciELO no se especificó ningún parámetro.
Tabla 1 Cadenas de palabras clave utilizadas en la búsqueda de artículos.
Fuente: Elaboración de los autores.
Base de datos
Cadenas de búsqueda
WoS
TS=(governance AND (nanomedicine* OR (nanotechnology NEAR (medicine OR medical)))) OR TI=((risks OR regulation OR ethics) AND (nanomedicine* OR (nanotechnology NEAR (medicine OR medical))))
Scopus
(TITLE-ABS-KEY(governance AND (nanomedicine* OR (nanotechnology W/15 (medicine OR medical)))) OR TITLE((risks OR regulation OR ethics) AND (nanomedicine* OR (nanotechnology W/15 (medicine OR medical))))) AND DOCTYPE(ar)
SciELO
(governance OR risks OR regulation OR ethics) AND (nanomedicine* OR (nanotechnology NEAR (medicine OR medical)))
La búsqueda se realizó en julio de 2021 y produjo 103 resultados (46 en WoS, 47 en Scopus y 10 en SciELO). Después de eliminar los artículos repetidos y descartar aquellos que no estaban relacionados directamente con la gobernanza de la nanomedicina, se obtuvieron 36 artículos para llevar a cabo la revisión de la literatura. En la Figura 1 se resume la metodología empleada en la búsqueda y filtrado de artículos.
Figura 1 Diagrama de flujo de la búsqueda y filtrado de artículos.

Fuente: Elaboración de los autores.
Los 36 artículos seleccionados se rastrearon en la plataforma Dimensions (www.dimensions.ai) para conocer el impacto obtenido en cuanto a número de citas y presencia en Internet.
Resultados y discusión
Los artículos se clasificaron en cuatro rubros: aspectos generales de gobernanza, regulación, ética y riesgos. Las Tablas 2, 3, 4 y 5 reúnen los artículos de cada una de estas cuatro áreas, respectivamente. Las tablas muestran la referencia de los artículos, los países de los autores de correspondencia y los principales hallazgos o contribuciones. También se incluyen dos parámetros de Dimensions: “total de citas” y “nivel de atención Altmetrics”. El primer parámetro indica el número de veces que un artículo ha sido citado en todas las publicaciones indexadas en Dimensions; el segundo es un valor que muestra la cantidad de atención que ha recibido un artículo en Internet, es decir, menciones en blogs, Wikipedia, redes sociales como Reddit, Twitter y Facebook, etc. En cada tabla los artículos están ordenados de forma cronológica, del más antiguo al más reciente.
Tabla 2 Artículos sobre aspectos generales de gobernanza.
Fuente: Elaboración de los autores.
Referencia
País
Principales hallazgos / contribuciones
Total de citas
Nivel de atención Altmetrics
Nerlich, Clarke y Ulph (2007)
Reino Unido
Se indaga la percepción que tienen los adultos jóvenes sobre los riesgos y beneficios de la nanomedicina. Hay una mejor percepción hacia los trata mientos de una sola dosis. Los hombres muestran una actitud más favorable hacia la nanomedicina que las mujeres.
18
8
Sandler (2009)
Estados Unidos
Los problemas de la nanomedicina no se restringen únicamente a cuestiones de riesgos y justicia distributiva; también existen problemas éticos, sociales y legales que tienen que considerarse.
14
-
Vivekanandan (2009)
India
Los principales desafíos de gobernanza que enfrenta la nanomedicina en India son la poca vinculación entre centros de investigación y empresas, financiamiento limitado, escasa participación del sector privado, poco interés en la investigación de riesgos, entre otros.
2
-
de Cózar Escalante (2012)
España
Se identifican cuestiones relacionadas con la nanomedicina y nanobiotecnología que deben analizar se desde las ciencias sociales: gestión de riesgos, transferencia tecnológica, bioética, biopolítica y sostenibilidad.
-
-
Giroto Carelli Hermes y Haida mus de Oliveira Basto (2014)
Brasil
Se analizan algunos logros de la nanomedicina en Brasil hasta el año 2013 y se exploran su implicaciones éticas, toxicológicas y ambientales.
-
-
Tabla 3 Artículos sobre regulación.
Fuente: Elaboración de los autores.
Referencia
País
Principales hallazgos / contribuciones
Total de citas
Nivel de atención Altmetrics
De Ville (2008)
Estados Unidos
Se propone la creación de un registro obligatorio para recabar datos sobre la seguridad y eficacia de los productos nanomédicos que ya se encuentran en el mercado. El objetivo es rastrear la experiencia de los usuarios para evitar riesgos.
6
-
Chowdhury (2010)
Países Bajos
Se plantea que la regulación de los productos nanomédicos en la Unión Europea podría guiarse de la normatividad a medicamentos pediátricos y de terapia avanzada para abordar asuntos de farmacovigilancia.
15
-
Marchant et al. (2010)
Estados Unidos
No hay tratados internacionales sobre regulación de la nanomedicina, pero existen algunas iniciativas informales que promueven l3 cooperación internacional en este tema.
13
-
Anand, Srivastava y Sarma (2011)
India
Se proponen algunas acciones para fortalecer la regulación de la nanomedicina en India, por ejemplo, el diseño y adopción de estándares voluntarios en la industria nanomédica y el establecimiento de normas locales con el apoyo de organismos inter nacionales.
2
-
Altenstetter, 2011
Estados Unidos
Se enfatiza que la seguridad de los pacientes debe ser un asunto a considerarse durante todo el ciclo regulatorio de la nanomedicina, desde la evaluación clínica y los controles previos a la comerciali zación hasta el uso final de los productos nanomédicos en diversos entornos clínicos.
8
-
Dorbeck-Jung y Chowdhury, 2011
Países Bajos
Hay deficiencias en la regulación de la nanomedicina en la Unión Europea, por ejemplo, falta de definiciones claras respecto a los productos nanomédicos, limitaciones en los estándares de seguridad, calidad y eficacia, y dificultades en la evaluación de impactos ambientales.
16
-
Wolf y Jones, 2011
Estados Unidos
Ante los riesgos que implica la investigación nanomédica en seres humanos, se propone la creación de una agencia que vigile y regule estas actividades.
11
4
D'Silva, Robinson y Shelley-Egan (2012)
Países Bajos
La incertidumbre en el marco regulatorio de la nanomedicina no ha inhibido la inversión en este sector. Esto se debe que las distintas partes involucradas (empresas, organizaciones no gubernamentales, grupos de usuarios) han desarrollado mecanismos alternativos de regulación tales como códigos de conducta, estándares voluntarios y procedimientos de vigilancia.
3
1
Gispert (2012)
España
Se propone utilizar el principio precautorio como una guía en la regulación de productos nanomédicos en la Unión Europea.
3
-
Delgado Ramos y Hernández Burciaga (2013)
México
Se revisen los avances científicos en nanomedicina aplicada al cáncer cerebral y se propone un modelo normativo para la gestión de riesgos en nanomedicina que abarca aspectos éticos y sociales.
-
-
Andorno y Biller-Andorno (2014)
Suiza
Se enfatiza la importancia de adoptar el principio precautorio en la regulación de la nanomedicina para prevenir daños potenciales relacionados con los productos nanomédicos.
3
-
Cancino, Marangoni y Zucolotto (2014)
Brasil
Brasil tiene un importante potencial para el desarrollo y comercialización de productos nanomédicos, pero carece de estándares y regulaciones adecuadas para este sector.
9
3
Bawa (2016)
Estados Unidos
En lo que respecta a nanotecnología y nanomedicina, el marco regulatorio de la FDA tiene definiciones poco claras de lo que es nano. Se propone una nueva definición de nanotecnología que es más adecuada para el ámbito regulatorio.
-
-
Vidal Correa (2016)
México
Se comparan las regulaciones de Estados Unidos y la Unión Europea en materia de nanotecnología y nanomedicina. Se concluye que la normatividad de sustancias químicas es limitada para abarcar lo nano, y que la normatividad para medicamentos y productos sanitarios presenta deficiencias en cuanto a la clasificación de los productos nanomédicos.
-
-
Rahim (2019)
Australia
Ante la falta de un marco normativo específico para la nanomedicina en Australia, se propone adoptar un enfoque de metarregulación en el que las empresas se regulen a sí mismas bajo la supervisión del Estado.
-
-
Tabla 4 Artículos sobre ética.
Fuente: Elaboración de los autores.
Referencia
País
Principales hallazgos / contribuciones
Total de citas
Nivel de atención Altmetrics
Khushf (2007)
Estados Unidos
Se analizan cuestiones éticas de la nanomedicina relacionadas con la propiedad intelectual, consentimiento informado, relación médico-paciente y medicina personalizada.
16
-
Resnik y Tinkle (2007)
Estados Unidos
Hasta 2007, las preocupaciones éticas sobre nanomedicina se orientaban principalmente a la evaluación, gestión y comunicación de riesgos. Se pronostica que a futuro aumenten las preocupaciones éticas en torno a justicia social, acceso a la atención médica y transhumanismo.
71
-
Bawa y Johnson (2009)
Estados Unidos
Se discuten aspectos de la nanomedicina que despiertan preocupaciones éticas, por ejemplo, riesgos toxicológicos de los nanomateriales, inequidad en el acceso a productos nanomédicos y concen tración de patentes en unas pocas empresas multinacionales.
29
-
Álvarez-Díaz (2011)
México
Partiendo de la bioética, se analizan algunas preocupaciones derivadas de la nanomedicina tales como el consentimiento informado y la inequidad en el acceso a los productos nanomédicos.
-
-
Kimmelman (2012)
Canadá
Se propone un modelo ético de investigación clínica para prevenir externalidades negativas (perjuicios a terceros) tales como daños a trabajadores por exposición a nanomateriales o contaminación del medio ambiente.
5
-
Haker (2013)
Estados Unidos
El enfoque ELSA (ethical, legal and social aspects) se ha usado para evaluar las implicaciones éticas, jurí dicas y sociales de tecnologías emergentes como la genómica. Se propone aplicar el enfoque ELSA en nanomedicina, integrando el análisis de riesgos de nanomateriales en la parte ética.
-
-
Ganau et. al. (2016)
Estados Unidos
Se propone un marco ético para informar a los usuarios finales los beneficios y posibles riesgos de los productos nanomédicos.
-
-
Evans, McNamee y Guy (2017)
Reino Unido
Se identifican algunas preocupaciones éticas asociadas con el uso de nanobiosensores en los deportes, entre las que se encuentran el mal manejo de datos, efectos de los nanomateriales en la salud de los atletas y problemas de inequidad en el deporte.
7
9
Lima-Dora, Teixeira-Primo y de-Morales-Soares-Araújo (2019)
Brasil
Ante la incipiente regulación del sector nanomédico en Brasil, se hace una reflexión bioética sobre los posibles riesgos a la salud y medio ambiente de los nanomedicamentos. Se plantea la adopción del principio precautorio en el sector nanomédico y la aplicación de un enfoque transdisciplinario en la formulación de los marcos normativos.
-
-
Tabla 5 Artículos sobre riesgos.
Fuente: Elaboración de los autores.
Referencia
País
Principales hallazgos / contribuciones
Total de citas
Nivel de atención Altmetrics
Reilly (2007)
Canadá
Se explora el potencial que tienen los nanotubos de carbono para usarse como transportadores de radiofármacos en tratamientos de medicina nuclear, pero también se analizan los posibles riesgos toxicológicos de estas nanoestructuras
72
-
Tyshenko (2008)
Canadá
Se exploran los posibles riesgos toxicológicos del uso de material genético a nanoescala en sistemas de administración de fármacos.
4
-
Hogle (2012)
Estados Unidos
Se recomienda la creación de un grupo de trabajo interinstitucional para recabar y compartir in formación sobre riesgos en la investigación nanomédica.
7
-
Smolkova, Dusinska y Gabelova (2017)
Eslovaquia
Se revisan estudios sobre la posible toxicidad epigenética de las nanomedicinas. El tema ha sido poco explorado y la evidencia disponible no es concluyente.
35
-
Halappanavar et al. (2018)
Canadá
Se explora el potencial que tiene la biología de sistemas en la evaluación de riesgos de los nanomateriales empleados en nanomedicina.
33
4
Mahapatra et al. (2018)
Reino Unido
Se recoge la opinión de 66 expertos en nanomedicina de la Unión Europea acerca de pertinencia de los procedimientos actuales para la evaluación de riesgos ambientales de los productos nanomédicos.
14
-
Rycroft et al. (2018)
Estados Unidos
Se propone un análisis de decisiones multicriterio para evaluar los riesgos de los productos nanomédicos.
20
-
En la Figura 2A se observa la distribución porcentual de los artículos por tema. La regulación es el tema que concentra la mayor cantidad de artículos (41.67 %), seguido por ética (25%), riesgos (19.44 %) y, finalmente, aspectos generales de gobernanza (13.89%). En la Figura 2B se presenta la distribución porcentual de los artículos por país. Se distinguen tres regiones prominentes en publicaciones: América anglosajona (color naranja), Unión Europea (azul) y América Latina (verde). Actualmente, Reino Unido no forma parte de la Unión Europea, pero en este análisis se le considera dentro de ella porque todos sus artículos son de fecha anterior al Brexit (salida del Reino Unido de la Unión Europea en enero de 2020). Los únicos países de América Latina que aparecen son México y Brasil; en otro trabajo (Invernizzi et al., 2015) se ha reportado que estos dos países lideran la producción científica sobre nanotecnología en la región.
Figura 2 Distribución de los artículos por tema (A) y por país (B).
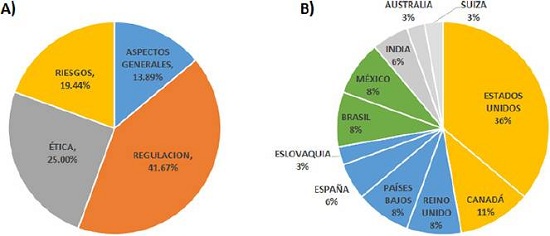
Fuente: Elaboración de los autores.
En lo que respecta a los parámetros de Dimensions, en las Tablas 2, 3, 4 y 5 se observa que los artículos más citados pertenecen a las áreas de riesgos y ética: el trabajo de Reilly (2007), que versa sobre los riesgos toxicológicos de los nanotubos de carbono, tiene 72 citas, mientras que el artículo de Resnik y Tinkle (2007), cuyo tema son las preocupaciones éticas derivadas de la nanomedicina, tiene 71 citas. Del total de 36 artículos revisados, solo 6 tienen actividad en redes sociales (nivel de atención Altmetrics). Esto indica que la mayoría los artículos no ha tenido difusión entre el público en general.
Aspectos generales de gobernanza
Los artículos que se clasificaron en este rubro abordan los siguientes temas: gobernanza de la nanomedicina en países específicos como India y Brasil (Vivekanandan, 2009; Giroto Carelli Hermes y Haidamus de Oliveira Basto, 2014), percepción de la nanomedicina en adultos jóvenes (Nerlich, Clarke y Ulph, 2007) e implicaciones éticas y sociales de la nanomedicina (Sandler, 2009; de Cózar Escalante, 2012). Destaca el trabajo de Vivekanandan (2009) porque explora simultáneamente varios aspectos de la gobernanza que van desde lo financiero hasta lo ético. Vivekanandan identificó los principales desafíos de gobernanza que enfrentaba la nanomedicina en India durante la primera década de este siglo: a) escasa vinculación entre centros de investigación y empresas; b) mala coordinación de políticas; c) limitaciones de financiamiento; d) poca participación del sector privado; e) baja prioridad a la investigación de riesgos; f) fuerte influencia de la globalización en las agendas de investigación, y, g) polarización del debate público. Este autor señala varias situaciones que ilustran estos desafíos. Por ejemplo, la mala coordinación de políticas se observa en los objetivos contradictorios de algunas dependencias gubernamentales de India relacionadas con la investigación y desarrollo (I+D) en nanomedicina. Tal es el caso del Ministerio de Salud y Bienestar Familiar (Ministry of Health and Family Welfare) y el Departamento de Ciencia y Tecnología (Department of Science and Technology): mientras que el primero establece que se debe garantizar la seguridad de los nuevos medicamentos, el segundo prioriza la investigación básica y aplicada sin prestar mucha atención a la investigación de riesgos. En lo que concierne a la influencia de la globalización en la definición de agendas de investigación, Vivekanandan señala que India debe orientar el desarrollo de la nanomedicina a resolver problemas locales y evitar seguir de forma acrítica las tendencias internacionales: se debe priorizar la I+D en enfermedades infecciosas, que tienen una elevada tasa de mortalidad en India, en vez hacerlo en otro tipo de enfermedades como las cardiovasculares, que son más frecuentes en los países desarrollados pero que tienen poca incidencia en India. Respecto al debate de los pros y contras de la nanomedicina, Vivekanandan advierte que la adopción de posiciones extremas, tanto por parte de los defensores como de los críticos de la nanomedicina, podría generar desconfianza y rechazo entre el público, tal como ha ocurrido con el debate de los organismos genéticamente modificados.
Regulación de la nanomedicina
En algunas regiones y países que se abarcaron en esta revisión de la literatura, se identificó la no existencia de marcos normativos específicos para la nanomedicina, pues esta se rige por legislaciones ya existentes aplicables a medicamentos y dispositivos médicos; es el caso, por ejemplo, de la Unión Europea (Gispert, 2012), Brasil (Cancino, Marangoni y Zucolotto, 2014) y Australia (Rahim, 2019). Ante esta incertidumbre regulatoria, se han propuesto algunos mecanismos alternativos de regulación tales como códigos de conducta, estándares voluntarios y procedimientos de vigilancia (D’Silva, Robinson y Shelley-Egan, 2012). Un ejemplo de esto es el trabajo de Anand, Srivastava y Sarma (2011), en el que se sugiere implementar estándares voluntarios en la industria nanomédica de la India para tener un mejor control sobre impactos ambientales, peligros ocupacionales, eliminación de desechos, etcétera.
Vidal Correa (2016) señala la importancia de definir adecuadamente los términos nanotecnología, nanomaterial, nanopartícula, entre otros, en el contexto jurídico. En este sentido, Bawa (2016) reporta que la regulación de los productos nanomédicos en el marco regulatorio de la Administración de Medicamentos y Alimentos de Estados Unidos (FDA, por sus siglas en inglés) se ha visto obstaculizada por la falta de definiciones claras sobre nanomedicina y nanotecnología. Este problema también se ha identificado en la regulación de la Unión Europea (Dorbeck-Jung y Chowdhury, 2011). En términos simples, la nanomedicina se puede definir como la aplicación de la nanotecnología en medicina (Szelenyi, 2012; Jain, 2017), pero esta definición requiere esclarecer primero el concepto de nanotecnología. Una de las definiciones de nanotecnología más conocidas es la que propone la Iniciativa Nacional de Nanotecnología de los Estados Unidos (NNI, por sus siglas en inglés), que dice que lo siguiente: Nanotechnology is the understanding and control of matter at the nanoscale, at dimensions between approximately 1 and 100 nanometers, where unique phenomena enable novel applications1 (NNI, S. f.). Desafortunadamente, esta definición de nanotecnología no es del todo compatible con los desarrollos científicos e innovaciones llevadas a cabo en el campo de la nanomedicina. Muchas nanoestructuras empleadas en nanomedicina no se ajustan al rango de tamaño establecido en esta definición; tal es el caso de los liposomas y otros nanotrasportadores cuyo tamaño puede superar el límite de los 100 nm (Crommelin, Van Hoogevest y Storm, 2020). Bawa (2016) señala que el rango de 1 a 100 nm es un límite arbitrario que deja fuera de la definición a varios productos nanomédicos y, a manera de ejemplo, menciona algunos nanomedicamentos que ya se encuentran en el mercado y que superan el tamaño de 100 nm: Abraxane® (~ 130 nm), Myocet® (~ 190 nm), DepoCyt® (10,000-20,000 nm), Amphotec® (~ 130 nm), Epaxal® (~ 150 nm), Inflexal® (~ 150 nm), Lipodox® (180 nm), Oncaspar® (50-200 nm), por mencionar algunos. La FDA, en su informe más reciente sobre nanotecnología (FDA, 2020), aclara que no cuenta con definiciones reglamentadas de los términos “nanotecnología”, “nanomaterial”, “nanoescala” y otros relacionados, pero utiliza dos criterios para determinar si un producto involucra nanotecnología: 1) al menos una de las dimensiones de la partícula está en el rango de 1 a 100 nm, y, 2) se observan propiedades novedosas atribuibles al tamaño de partícula hasta un límite de 1000 nm. Estos criterios de la FDA se asemejan a la definición de nanotecnología de la NNI, en el sentido de que restringen lo nano a un tamaño fijo. Bawa (2016) afirma que se deben establecer definiciones más adecuadas para abordar los asuntos regulatorios y propone la siguiente definición de nanotecnología: The design, characterization, production, and application of structures, devices, and systems by controlled manipulation of size and shape at the nanometer scale (atomic, molecular, and macromolecular scale) that produces structures, devices, and systems with at least one novel/ superior characteristic or property.2 Bawa considera que esta definición sería útil en el entorno regulatorio porque se centra en las propiedades novedosas de la materia atribuibles a la nanoescala, sin restringir esta a un tamaño fijo que excluya a ciertos productos nanomédicos.
En algunos de los artículos revisados se destaca la propuesta de adoptar el principio precautorio en la regulación de la nanomedicina (Gispert, 2012; Andorno y Biller-Andorno, 2014; Lima-Dora, Teixeira-Primo y de-Moraes-Soares-Araújo, 2019). Este principio establece que “cuando una actividad amenaza con dañar la salud humana o el medio ambiente, deben adoptarse medidas de tutela anticipadas y pertinentes, aún cuando todavía no se hayan establecido plenamente y de modo científico las relaciones de causa-efecto” (Berger y Filho, 2022). En el caso de la nanomedicina, aún hay incertidumbre sobre los posibles efectos negativos de los nanomateriales en la salud humana, por lo que se justifica la implementación del principio precautorio.
Otro asunto importante que se discute en la literatura es la necesidad de regular y vigilar la investigación nanomédica en seres humanos. Wolf y Jones (2011) señalan que los riesgos de este tipo de investigación no se restringen solo a las personas que participan como sujetos de estudio, sino que también se extienden a los trabajadores de los laboratorios, contactos cercanos y medio ambiente. Wolf y Jones proponen la creación de una agencia federal en Estados Unidos para vigilar la investigación nanomédica en seres humanos. Las principales funciones de esta agencia serían 1) revisar los protocolos de investigación; 2) monitorear los ensayos clínicos, y, 3) brindar orientación a los investigadores en cuestiones éticas, científicas y sociales. La propuesta de estos autores se basa en una revisión de los modelos de vigilancia que se han aplicado en otras áreas de investigación igualmente delicadas, que involucran pruebas en humanos, tales como la terapia génica, investigación pediátrica, trasplante de tejidos fetales y xenotrasplantes (trasplante de células, tejidos u órganos entre especies distintas).
Duncan y Gaspar (2011) refieren otras cuestiones importantes sobre la regulación de la nanomedicina: a) desarrollo de mecanismos que garanticen la seguridad de los nanomedicamentos similares o genéricos; b) necesidad de que las agencias reguladoras estén actualizadas con los rápidos avances de la nanomedicina, y, c) monitoreo proactivo de las legislaciones para evitar la existencia de brechas regulatorias.
Aspectos éticos de la nanomedicina
La naturaleza altamente interdisciplinaria de la nanomedicina implica el trabajo en conjunto de especialistas de distintas áreas como ingeniería, medicina, biología, física, etc. En cada una de estas profesiones, los códigos de ética o el énfasis que se le da a ciertos valores éticos como la eficiencia o utilidad pueden variar. Por esta razón, Bawa y Johnson (2009) señalan la necesidad de contar con un código de ética específico para la nanomedicina. En este sentido, López Goerne y Paoli Bolio (2009) elaboraron una propuesta de un código de ética para la nanomedicina en el que abordan aspectos como las relaciones médico-paciente, experimentación en seres humanos, medio ambiente, políticas públicas, educación y negocios en el sector de los nanomedicamentos.
La llegada de los productos nanomédicos al mercado y a los usuarios finales genera preocupaciones éticas debido a los posibles riesgos de estos productos. Ganau et al. (2016) consideran que los usuarios finales de los productos nanomédicos deben estar informados sobre los beneficios y riesgos de estos productos, y para ello proponen el marco nanoético que está representado en la Figura 3. Este marco está compuesto por seis etapas que se extienden a lo largo de toda la vida de útil de los productos nanomédicos: 1) identificar las necesidades clínicas y el contexto en el que se implementará el producto nanomédico; 2) puntualizar sus alcances; 3) evaluar sus ventajas y limitaciones; 4) hacer comparaciones con estándares de referencia, siempre que sea posible; 5) analizar el impacto percibido por los pacientes, y, 6) monitorear los efectos a largo plazo de los nanoproductos. Ganau et al. consideran que la implementación de este marco nanoético permitiría a los científicos y médicos comunicar de mejor manera los pros y contras de los productos nanomédicos a los pacientes, de tal manera que estos puedan tomar decisiones más informadas sobre el uso de dichos productos.
Figura 3 Propuesta de marco ético para aplicarse en el diseño, producción y comercialización de los productos nanomédicos.
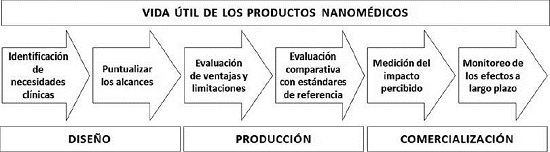
Fuente: Tomado y adaptado de Ganau et al. (2016).
Otros aspectos de la nanomedicina que se han examinado desde el punto de vista ético son la concentración de patentes en unas pocas empresas multinacionales (Bawa y Johnson, 2009), inequidad en el acceso a los productos nanomédicos (Álvarez-Díaz, 2011), externalidades negativas en la investigación clínica (Kimmelman, 2012) y las preocupaciones éticas relacionadas con los nuevos usos de los nanobiosensores en los deportes (vans, McNamee y Guy, 2017).
Evaluación de riesgos de los productos nanomédicos
Uno de las áreas más importantes de la evaluación de riesgos es la nanotoxicología, es decir, el estudio de los efectos adversos de los nanomateriales en seres vivos y el medio ambiente. En esta revisión de la literatura se identificaron algunos trabajos relacionados con la toxicidad de nanomateriales a nivel celular y genético. Reilly (2007) exploró los riesgos toxicológicos de los nanotubos de carbono en nanomedicina. Estas nanoestructuras tienen potencial para usarse como transportadores de radiofármacos en tratamientos de medicina nuclear, pero es posible que representen algunos riesgos toxicológicos. Reilly menciona que los nanotubos de carbono insolubles en agua son altamente tóxicos para distintos tipos de células, entre las que se encuentran los queratinocitos humanos, las células neuronales del cerebro de rata y células embrionarias de riñón humano. Por otra parte, los nanotubos de carbono solubles en agua tienen una mejor biocompatibilidad y aparentemente no producen efectos nocivos en las células, al menos en experimentos in vitro; sin embargo, Reilly considera que se deben realizar más estudios, sobre todo in vivo, antes de emplear estas nanoestructuras en nanomedicina. Otro asunto que se ha analizado desde la nanotoxicología son los posibles riesgos de utilizar material genético nanoestructurado en la administración de fármacos (Tyshenko, 2008). A diferencia de los nanomateriales inorgánicos, el material genético presenta una excelente biocompatibilidad y por lo tanto, podría usarse en la construcción de nanoestructuras para el transporte de fármacos. Aunque los riesgos del material genético nanoestructurado parecen ser muy bajos en comparación con los riesgos de otros nanomateriales, Tyshenko advierte que se deben hacer estudios toxicológicos del material genético nanoestructurado para saber qué ocurre con él dentro del cuerpo humano, una vez que se degrada. Otro tema de preocupación en la nanotoxicología es la toxicidad epigenética de los nanomedicamentos. Smolkova, Dusinska y Gabelova (2017) mencionan que este tema ha sido poco explorado y que los datos disponibles provienen principalmente de estudios in vitro y en animales, por lo que sería deseable llevar a cabo nuevos estudios que den información sobre la toxicidad epigenética en humanos.
Hace más de una década Vivekanandan (2009) señalaba la poca prioridad que se le daba a la investigación de riesgos de nanomateriales usados en aplicaciones médicas, por lo que se tenía escasa información para evaluar los riesgos de los productos nanomédicos. Esto ha venido cambiando a medida que se genera nuevo conocimiento respecto a los nanomateriales; ya no solo sobre sus propiedades, sino también sobre sus implicaciones en seguridad, salud y medio ambiente. En tiempos más recientes, Rycroft et al. (2018) refieren que el principal desafío enfrentado por la evaluación de riesgos en nanomedicina ya no es la falta de información como ocurría en el pasado, sino el cómo integrar toda la información que hoy se tiene disponible. En este sentido, Rycroft et al. (2018) proponen una metodología basada en el análisis de decisiones multicriterio para la evaluación de riesgos, la cual se esquematiza en la Figura 4. Al inicio del desarrollo de un producto nanomédico se deben plantear varias alternativas: por ejemplo, en el desarrollo de un tratamiento contra el cáncer se podrían proponer distintos nanotransportadores como dendrímeros, liposomas, nanopartículas metálicas, etc. Posteriormente, establecer los criterios para evaluar cada una de las alternativas considerando cuatro rubros: seguridad, eficacia, costos de I+D y sustentabilidad. A cada uno de estos rubros se le asigna una ponderación distinta de acuerdo con su importancia. Después se recopila y analiza la evidencia disponible (publicaciones científicas, estudios de caso, resultados de pruebas preclínicas, etc.) y se asignan puntajes en cada rubro. Finalmente, se calcula el puntaje total para cada alternativa y se elige la que obtenga mejor calificación. La propuesta de estos autores es interesante porque permite evaluar los riesgos de manera objetiva, contempla varios tipos de riesgos y promueve el uso de esta información en la toma de decisiones respecto al diseño de productos nanomédicos.
Figura 4 Metodología de análisis de decisiones multicriterio para el diseño de productos nanomédicos.

Fuente: Tomado y adaptado de Rycroft et al. (2018).
Desafíos de gobernanza en la industria nanofarmacéutica
La nanomedicina adquiere una posición cada vez más relevante dentro de la industria farmaceútica, lo cual se ve reflejado en el incremento experimentado en el mercado de la nanomedicina en los últimos años. En 2009, el tamaño del mercado global de nanomedicina fue aproximadamente de 53 mil millones de dólares; en 2017, de 134.4 mil millones de dólares, y se prevé que para 2022 será de 293.1 mil millones de dólares (Gadekar et al., 2021). A pesar de este crecimiento, hay algunos desafíos de gobernanza, principalmente de regulación y riesgos, que la nanomedicina enfrenta dentro de la industria farmacéutica. Hay carencia de regulaciones o estándares específicos para la nanomedicina en cuestiones de manufactura, control de calidad, seguridad y evaluación de la eficacia de los nanomedicamentos. Por ejemplo, la industria farmacéutica aplica buenas prácticas de laboratorio (BPL) para lograr la seguridad y calidad en sus productos; sin embargo, actualmente no se tienen BPL específicas para la nanomedicina (Zhang et al., 2020). Tampoco se cuenta con procedimientos estandarizados para evaluar los riesgos toxicológicos de los nanomedicamentos (Wu, Wang y Li, 2020).
Conclusiones
La revisión sistemática de literatura realizada en este trabajo permitió trazar un panorama de la gobernanza de la nanomedicina. Los artículos que se revisaron abordan temas sobre regulación, ética y evaluación de riesgos de la nanomedicina. En materia de regulación se encontró que en varios países no hay regulaciones específicas para la nanomedicina y que la normatividad aplicable a productos nanomédicos, tanto de Europa como de Estados Unidos, ha tenido dificultades relacionadas con la falta de definiciones precisas sobre nanotecnología, nanomedicina y su intersección. En el tema ético se ubicaron artículos que abordan preocupaciones en torno a la equidad en el acceso a los productos nanomédicos, la concentración de patentes en pocas empresas, el nuevo uso los de nanobiosensores en los deportes, el consentimiento informado, entre otros. En cuanto a evaluación de riesgos, se exploraron estudios nanotoxicológicos sobre nanomateriales con potenciales aplicaciones en medicina, tales como los nanotubos de carbono y material genético nanoestructurado. A través de una consulta a la plataforma Dimensions se encontró que la mayoría de estos artículos están citados en otros trabajos académicos, pero tienen poca o nula presencia en redes sociales. Esto puede ser un indicio de que el público en general tiene poco interés en estos temas.
Esta revisión también permitió visualizar cómo se ha desarrollado la gobernanza de la nanomedicina a lo largo de tiempo. Algunos temas de gobernanza han sufrido cambios; por ejemplo, en uno de los artículos más antiguos de esta revisión (Vivekanandan, 2009), se reportaba que la investigación de riesgos tenía poca prioridad; en contraste, en un trabajo más reciente (Rycroft et al., 2018), se menciona que la información sobre riesgos se ha incrementado de manera sustancial en los últimos años. Esto va de la mano con un incremento en la visibilidad del tema de riesgos a la salud y el medio ambiente a partir del uso de nanomateriales manufacturados. Por ejemplo, los estudios sobre los riesgos de los nanomateriales manufacturados se han incrementado exponencialmente; en PubMed (2005) se ubicaron 24 artículos y en 2015 cerca de 4 mil (Shvedova, Pietroiusti y Kagan, 2016). Esto marca una tendencia importante en la información científica disponible que nutre la toma de decisiones respecto al uso de la nanotecnología en diversos campos. Por otra parte, hay asuntos donde no se han observado cambios importantes. En 2011 Dorbeck-Jung y Chowdhury reportaban deficiencias en la regulación europea debidas a la falta de definiciones precisas de lo que es nano; posteriormente, Bawa (2016) reportó la misma situación para el caso de la regulación estadounidense, y actualmente, en el informe más reciente sobre nanotecnología de la FDA (2020), se sigue observando ambigüedad en este tema.
La revisión de literatura presentada en este artículo permitió identificar las principales áreas de la gobernanza en nanomedicina: regulación, aspectos éticos y evaluación de riesgos. Las futuras revisiones que se hagan sobre el tema podrían centrarse en alguna de estas áreas en particular.
Los principales temas de gobernanza que se han estudiado en América Latina son la carencia de regulaciones adecuadas (Cancino, Marangoni y Zucolotto, 2014; Lima-Dora, Teixeira-Primo y de-Moraes -Soares- Araújo, 2019) y las implicaciones éticas de la nanomedicina (López Goerne y Paoli Bolio, 2009; Álvarez-Díaz, 2011; Delgado Ramos y Hernández Burciaga, 2013). Esta disciplina tiene gran potencial para atender los problemas de salud que existen en América Latina, pero sin las regulaciones y políticas adecuadas, su alcance social será limitado. Por tal motivo es necesario que se fortalezca la gobernanza de la nanomedicina en la región.
Referencias
- Altenstetter, Christa. (2011). Medical device regulation and nanotechnologies: determining the role of patient safety concerns in policymaking. Law & Policy, 33 (2): 227-55. https://doi.org/10.1111/j.1467-9930.2010.00337.x
- Álvarez-Díaz, Jorge Alberto. (2011). Retos de la bioética en la medicina del siglo XXI. Revista Peruana de Medicina Experimental y Salud Publica, 28 (4): 657-63.
- Anand, Manish, Nidhi Srivastava y Shilpanjali Sarma. (2011). Policy and ethical concerns in nanotechnology safety: case of Indian Health Sector. Journal of Biomedical Nanotechnology, 7 (1): 34-35. https://doi.org/10.1166/jbn.2011.1188
- Andorno, Roberto y Nikola Biller-Andorno. (2014). The risks of nanomedicine and the precautionary principle. En Bert Gordijn y Anthony Mark Cutter (eds.), In pursuit of nanoethics, 131-45. The International Library of Ethics, Law and Technology. Dordrecht: Springer Netherlands. https://doi.org/10.1007/978-1-4020-6817-1_9
- Anzaldo, Mónica, Michelle Chauvet y Luis A. Maldonado. (2014). Fondos públicos para la investigación en nanotecnologías en México y el cambio de paradigma de la política de CTI. Interciencia, 39 (1): 8-15.
- Basova, Tamara V., Evgeniia S. Vikulova, Svetlana I. Dorovskikh, Aseel Hassan y Natalya B. Morozova. (2021). The use of noble metal coatings and nanoparticles for the modification of medical implant materials. Materials & Design, 204 (junio): 109672. https://doi.org/10.1016/j.matdes.2021.109672
- Bawa, Raj. (2016). FDA and nano: baby steps, regulatory uncertainty and the bumpy road ahead. En Handbook of Clinical Nanomedicine: Law, Business, Regulation, Safety, and Risk, 1502. Nueva York: Taylor & Francis. https://doi.org/10.1201/b19910
- Bawa, Raj y Summer Johnson. (2009). Emerging issues in nanomedicine and ethics. En Fritz Allhoff y Patrick Lin (eds.), Nanotechnology & society: Current and emerging ethical issues, 207-23. Dordrecht: Springer Netherlands. https://doi.org/10.1007/978-1-4020-6209-4_11
- Bawa, Raj y Summer Johnson. (2020). Overview of ethical issues in nanomedicine. En Mousa, Bawa and Audette (eds.), The road from nanomedicine to precision. https://doi.org/10.1201/9780429295010
- Berger, Mauricio y Airton Guilherme Berger Filho. (2022). Nano-governance, nanoregulación y, ¿nano-ciudadanía? Mundo Nano. Revista Interdisciplinaria en Nanociencias y Nanotecnología, 15 (28): 1e-26e. https://doi.org/10.22201/ceiich.24485691e.2022.28.69659
- Bhatia, Pooja y Archana Chugh. (2017). A multilevel governance framework for regulation of nanomedicine in India. Nanotechnology Reviews, 6 (4): 373-82. https://doi.org/10.1515/ntrev-2016-0083
- Cancino, Juliana, Valéria S. Marangoni y Valtencir Zucolotto. (2014). Nanotecnologia em medicina: aspectos fundamentais e principais preocupações. Química Nova, 37 (junio): 521-26. https://doi.org/10.5935/0100-4042.20140086
- Caracciolo, Giulio. (2015). Liposome-protein corona in a physiological environment: challenges and opportunities for targeted delivery of nanomedicines. Nano-medicine: Nanotechnology, Biology and Medicine, 11 (3): 543-57. https://doi.org/10.1016/j.nano.2014.11.003
- Chen, X. y H. J. Schluesener. (2008). Nanosilver: a nanoproduct in medical application. Toxicology Letters, 176 (1): 1-12. https://doi.org/10.1016/j.toxlet.2007.10.004
- Chowdhury, Nupur. (2010). Regulation of nanomedicines in the EU: distilling lessons from the pediatric and the advanced therapy medicinal products approaches. Nanomedicine, 5 (1): 135-42. https://doi.org/10.2217/nnm.09.91
- Cózar Escalante, José Manuel de. (2012). Dimensiones de la investigación social sobre la nanobiotecnología. Revista Iberoamericana de Ciencia, Tecnología y Sociedad - CTS, 7 (20): 1-17.
- Crommelin, Daan J. A., Peter van Hoogevest y Gert Storm. (2020). The role of liposomes in clinical nanomedicine development. What now? Now what? Journal of Controlled Release, 318 (febrero): 256-63. https://doi.org/10.1016/j.jconrel.2019.12.023
- De Ville, Kenneth A. (2008). Law, regulation and the medical use of nanotechnology. En Fabrice Jotterand (ed.), Emerging conceptual, ethical and policy issues in bionanotechnology, 181-200. Philosophy and Medicine. Dordrecht: Springer Netherlands. https://doi.org/10.1007/978-1-4020-8649-6_11
- Delgado Ramos, Gian Carlo y Luis Alberto Hernández Burciaga. (2013). Avances e implicaciones éticosociales de la nanomedicina: una revisión desde el caso del cáncer cerebral. Mundo Nano. Revista Interdisciplinaria en Nanociencias y Nanotecnología, 6 (10): 63-85. https://doi.org/10.22201/ceiich.24485691e.2013.10.50965
- Dorbeck-Jung, Brbel R. y Nupur Chowdhury. (2011). Is the European medical products authorisation regulation equipped to cope with the challenges of nanomedicines? SSRN Scholarly Paper ID 1782436. Rochester, NY: Social Science Research Network. https://doi.org/10.1111/j.1467-9930.2011.00339.
- Duncan, Ruth y Rogerio Gaspar. (2011). Nanomedicine(s) under the microscope. Molecular Pharmaceutics, 8 (6): 2101-41. https://doi.org/10.1021/mp200394t
- D’Silva, Joel, Douglas K. R. Robinson y Clare Shelley-Egan. (2012). A game with rules in the making - how the high probability of waiting games in nanomedicine is being mitigated through distributed regulation and responsible innovation. Technology Analysis & Strategic Management, 24 (6): 583-602. https://doi.org/10.1080/09537325.2012.693671
- EGE. (2007). Opinion on the ethical aspects of nanomedicine - Opinion N° 21. https://op.europa.eu/en/publication-detail/-/publication/4d7d9c99-2129-42e1-993e-c815b91f256b/language-en/format-PDF/source-77404425#
- EU NanoSafety Cluster. (S. f.). NanoSafety Cluster. (Consultado, 4 de agosto de 2021). https://www.nanosafetycluster.eu/
- Evans, Robert, Michael McNamee y Owen Guy. (2017). Ethics, nanobiosensors and elite sport: the need for a new governance framework. Science and Engineering Ethics, 23 (6): 1487-1505. https://doi.org/10.1007/s11948-016-9855-1
- FDA. (2020). Nanotechnology-Over a decade of progress and innovation. https://www.fda.gov/media/140395/download
- Foladori, Guillermo. (2009). La gobernanza de las nanotecnologías. Sociológica (México), 24 (71): 125-53.
- Funari, Riccardo, Kang-Yu Chu y Amy Q. Shen. (2020). Detection of antibodies against SARS-CoV-2 spike protein by gold nanospikes in an opto-microfluidic chip. Biosensors and Bioelectronics, 169 (diciembre): 112578. https://doi.org/10.1016/j.bios.2020.112578
- Gadekar, Vedant, Yogeshwari Borade, Suraj Kannaujia, Kuldeep Rajpoot, Neelima Anup, Vishakha Tambe, Kiran Kalia y Rakesh K. Tekade. (2021). Nanomedicines accessible in the market for clinical interventions. Journal of Controlled Release, 330 (febrero): 372-97. https://doi.org/10.1016/j.jconrel.2020.12.034
- Ganau, Mario, Lara Prisco, Nikolaos Syrmos y Laura Ganau. (2016). Principles of nanoethics: theoretical models and clinical practice. En Handbook of Clinical Nanomedicine: Law, Business, Regulation, Safety, and Risk. Nueva York: Taylor & Francis. https://doi.org/10.1201/b19910
- Giroto Carelli Hermes, Elisangela y Paulo Roberto Haidamus de Oliveira Basto. (2014). Nanotecnologia: progresso científico, material, global e ético. Persona y Bioética, 18 (2): 107-18.
- Gispert, Ignasi. (2012). Overview of nanomedicines regulation in the European Union. En Jesús M. de la Fuente y V. Grazu (eds.), Frontiers of nanoscience, 4:487-507. Nanobiotechnology. Elsevier. https://doi.org/10.1016/B978-0-12-415769-9.00016-9
- Graur, F., R. Elisei, A. Szasz, H. C. Neagos, A. Muresan, L. Furcea, I. Neagoe, C. Braicu, G. Katona y M. Diudea. (2011). Ethical issues in nanomedicine. En Simona Vlad y Radu V. Ciupa (eds.), International Conference on Advancements of Medicine and Health Care through Technology, 9-12. IFMBE Proceedings. Berlín: Heidelberg: Springer. https://doi.org/10.1007/978-3-642-22586-4_3
- Haker, Hille. (2013). Nanomedicine and European Ethics - Part One. En Ethics for Graduate Researchers, 87-99. Oxford: Elsevier. https://doi.org/10.1016/B978-0-12-416049-1.00006-4
- Halappanavar, Sabina, Ulla Vogel, Hakan Wallin y Carole L. Yauk. (2018). Promise and peril in nanomedicine: the challenges and needs for integrated systems biology approaches to define health risk. WIREs Nanomedicine and Nanobiotechnology, 10 (1): e1465. https://doi.org/10.1002/wnan.1465
- Hogle, Linda F. (2012). Concepts of risk in nanomedicine research. The Journal of Law, Medicine & Ethics, 40 (4): 809-22. https://doi.org/10.1111/j.1748-720X.2012.00709.x
- Invernizzi, Noela, Guillermo Foladori, Eduardo Robles-Belmont, Edgar Záyago Lau, Edgar Arteaga Figueroa, Carolina Bagattolli, Tomás Javier Carrozza, Adriana Chiancone y William Urquijo. (2015). Nanotechnology for social needs: contributions from latin american research in the areas of health, energy and water. Journal of Nanoparticle Research, 17 (5): 233. https://doi.org/10.1007/s11051-015-3037-y
- Jain, Kewal K. (2017). Introduction. En Kewal K. Jain (ed.), The Handbook of Nanomedicine, 1-9. Nueva York, NY: Springer. https://doi.org/10.1007/978-1-4939-6966-1_1
- Khare, Vaibhav, Ajit K. Saxena y Prem N. Gupta. (2015). Chapter 15 - Toxicology considerations in nanomedicine. En Sabu Thomas, Yves Grohens, y Neethu Ninan (eds.), Nanotechnology applications for tissue engineering, 239-61. Oxford: William Andrew Publishing. https://doi.org/10.1016/B978-0-323-32889-0.00015-7
- Khushf, George. (2007). Upstream ethics in nanomedicine: a call for research. Nanomedicine, 2 (4): 511-21. https://doi.org/10.2217/17435889.2.4.511
- Kim, Jiyoung, Young-um Jo y Kun Na. (2020). Photodynamic therapy with smart nanomedicine. Archives of Pharmacal Research, 43 (1): 22-31. https://doi.org/10.1007/s12272-020-01214-5
- Kimmelman, Jonathan. (2012). Beyond human subjects: risk, ethics, and clinical development of nanomedicines. The Journal of Law, Medicine & Ethics, 40 (4): 841-47. https://doi.org/10.1111/j.1748-720X.2012.00712.x
- Lemine, O. M. (2019). Chapter 7 - Magnetic hyperthermia therapy using hybrid magnetic nanostructures. En Raghvendra Ashok Bohara y Nanasaheb Thorat (eds.), Hybrid nanostructures for cancer theranostics, 125-38. Micro and Nano Technologies. Elsevier. https://doi.org/10.1016/B978-0-12-813906-6.00007-X
- Li, Xue, Xue-Ning Zhang, Xiao-Dong Li y Jin Chang. (2016). Multimodality imaging in nanomedicine and nanotheranostics. Cancer Biology & Medicine, 13 (3): 339-48. https://doi.org/10.20892/j.issn.2095-3941.2016.0055
- Lima-Dora, Cristiana, Fabian Teixeira-Primo y Gabriela de-Moraes-Soares-Araújo. (2019). Reflexões bioéticas acerca da inovação em nanomedicamentos. Revista de Bioética y Derecho, 45: 197-212.
- López Goerne, Tessy María y Antonio Paoli Bolio. (2009). Ética para nanomedicina: primera propuesta para la elaboración de un código. Mundo Nano. Revista Interdisciplinaria en Nanociencias y Nanotecnología, 2 (2). https://doi.org/10.22201/ceiich.24485691e.2009.2.53585
- Mahapatra, Indrani, Julian R. A. Clark, Peter J. Dobson, Richard Owen, Iseult Lynch y Jamie R. Lead. (2018). Expert perspectives on potential environmental risks from nanomedicines and adequacy of the current guideline on environmental risk assessment. Environmental Science: Nano, 5 (8): 1873-89. https://doi.org/10.1039/C8EN00053K
- Marchant, Gary E., Douglas J. Sylvester, Kenneth W. Abbott y Tara Lynn Danforth. (2010). International harmonization of regulation of nanomedicine. Studies in Ethics, Law, and Technology, 3 (3). https://doi.org/10.2202/1941-6008.1120
- Meel, Roy van der, Einar Sulheim, Yang Shi, Fabian Kiessling, Willem J. M. Mulder y Twan Lammers. (2019). Smart cancer nanomedicine. Nature Nanotechnology, 14 (11): 1007-17. https://doi.org/10.1038/s41565-019-0567-y
- Nerlich, Brigitte, David D. Clarke y Fiona Ulph. (2007). Risks and benefits of nanotechnology: How young adults perceive possible advances in nanomedicine compared with conventional treatments. Health, Risk & Society, 9 (2): 159-71. https://doi.org/10.1080/13698570701306856
- NNI. (S. f.). What it is and how it works | National Nanotechnology Initiative. (Consultado: 9 de mayo de 2021). https://www.nano.gov/nanotech-101/what
- Ocampo, José Antonio. (2015). La gobernanza económica y social en el sistema de las Naciones Unidas. En Gobernanza global y desarrollo: Nuevos desafíos y prioridades de la cooperación internacional. Buenos Aires: Siglo Veintiuno.
- OCDE (Organización para la Cooperación y el Desarrollo Económicos). (S. f.). Technology governance. Technology governance. (Consultado: 23 de mayo de 2021). https://www.oecd.org/sti/science-technology-innovation-outlook/technology-governance/
- OCDE y Allianz. (S. f.). Opportunities and risks of nanotechnologies. https://www.oecd.org/science/nanosafety/44108334.pdf
- Pierre, Jon y B. Guy Peters. (2000). Governance, politics, and the State. Nueva York: St. Martin’s Press.
- Qiu, Guangyu, Zhibo Gai, Yile Tao, Jean Schmitt, Gerd A. Kullak-Ublick y Jing Wang. (2020). Dual-functional plasmonic photothermal biosensors for highly accurate severe acute respiratory syndrome coronavirus 2 detection. ACS Nano, 14(5): 5268-77. https://doi.org/10.1021/acsnano.0c02439
- Rahim, Mia M. (2019). Nanomedicine regulation in Australia. Alternative Law Journal, 44 (2): 133-37. https://doi.org/10.1177/1037969X18815737
- Rana, Vikas y Radhika Sharma. (2019). Chapter 5 - Recent advances in development of nano drug delivery. En Shyam S. Mohapatra, Shivendu Ranjan, Nandita Dasgupta, Raghvendra Kumar Mishra y Sabu Thomas (eds.), Applications of targeted nano drugs and delivery systems, 93-131. Micro and Nano Technologies. Elsevier. https://doi.org/10.1016/B978-0-12-814029-1.00005-3
- Reilly, Raymond M. (2007). Carbon nanotubes: potential benefits and risks of nanotechnology in nuclear medicine. Journal of Nuclear Medicine, 48 (7): 1039-42. https://doi.org/10.2967/jnumed.107.041723
- Renn, O. y M. C. Roco. (2006). Nanotechnology and the need for risk governance. Journal of Nanoparticle Research, 8 (2): 153-91. https://doi.org/10.1007/s11051-006-9092-7
- Resnik, David B. y Sally S Tinkle. (2007). Ethics in nanomedicine. Nanomedicine, 2(3): 345-50. https://doi.org/10.2217/17435889.2.3.345
- Rycroft, Taylor, Benjamin Trump, Kelsey Poinsatte-Jones e Igor Linkov. (2018). Nanotoxicology and nanomedicine: making development decisions in an evolving governance environment. Journal of Nanoparticle Research, 20 (2): 52. https://doi.org/10.1007/s11051-018-4160-3
- Saldivar-Tanaka, Laura. (2019). Regulando la nanotecnología. Mundo Nano. Revista Interdisciplinaria en Nanociencias y Nanotecnología, 12 (22): 37-57. https://doi.org/10.22201/ceiich.24485691e.2019.22.63140
- Sandler, Ronald. (2009). Nanomedicine and nanomedical ethics. The American Journal of Bioethics: AJOB, 9 (10): 16-17. https://doi.org/10.1080/15265160902995117
- Sassen, Saskia. (2010). Territorio, autoridad y derechos: De los ensamblajes medievales a los ensamblajes globales. Buenos Aires: Katz Editores.
- SCENIHR. (2015). Guidance on the determination of potential health effects of nanomaterials used in medical devices. Publications Office of the European Union. https://data.europa.eu/doi/10.2772/41391
- Shvedova, Anna, Antonio Pietroiusti y Valerian Kagan. (2016). Nanotoxicology ten years later: lights and shadows. Toxicology and Applied Pharmacology, The First Decade of Nanotoxicology: Achievements, Disappointments and Lessons, 299 (mayo): 1-2. https://doi.org/10.1016/j.taap.2016.02.014
- Smolkova, Bozena, Maria Dusinska y Alena Gabelova. (2017). Nanomedicine and epigenome. Possible health risks. Food and Chemical Toxicology, 109 (noviembre): 780-96. https://doi.org/10.1016/j.fct.2017.07.020
- Sportelli, Maria Chiara, Margherita Izzi, Ekaterina A. Kukushkina, Syed Imdadul Hossain, Rosaria Anna Picca, Nicoletta Ditaranto y Nicola Cioffi. (2020). Can nanotechnology and materials science help the fight against SARS-CoV-2? Nanomaterials (Basel, Switzerland), 10 (4). https://doi.org/10.3390/nano10040802
- Szelenyi, Istvan. (2012). Nanomedicine: evolutionary and revolutionary developments in the treatment of certain inflammatory diseases. Inflammation Research, 61 (1): 1-9. https://doi.org/10.1007/s00011-011-0393-7
- Tyshenko, Michael G. (2008). Medical nanotechnology using genetic material and the need for precaution in design and risk assessments. International Journal of Nanotechnology, 5 (1): 116-23. https://doi.org/10.1504/IJNT.2008.016551
- Vidal Correa, Laura Elena. (2016). Análisis comparativo de la regulación en nanotecnología en Estados Unidos y en la Unión Europea. Boletín mexicano de derecho comparado, 49 (147): 277-301. http://dx.doi.org/10.22201/iij.24484873e.2016.147.10646
- Vivekanandan, Jayashree. (2009). Nano applications, mega challenges: the case of the health sector in India. Studies in Ethics, Law, and Technology, 3 (3). https://doi.org/10.2202/1941-6008.1117
- WHO. (2013). Nanotechnology and human health: Scientific evidence and risk governance. Report of the WHO expert meeting 10-11 December 2012, Bonn, Germany. https://apps.who.int/iris/handle/10665/108626
- Wolf, Susan M. y Cortney M. Jones. (2011). Designing oversight for nanomedicine research in human subjects: systematic analysis of exceptional oversight for emerging technologies. Journal of Nanoparticle Research, 13 (4): 1449-65. https://doi.org/10.1007/s11051-011-0237-y
- Wu, Lin-Ping, Danyang Wang y Zibiao Li. (2020). Grand challenges in nanomedicine. Materials Science and Engineering: C, 106 (enero): 110302. https://doi.org/10.1016/j.msec.2019.110302
- Zhang, Chenyang, Liang Yan, Xin Wang, Shuang Zhu, Chunying Chen, Zhanjun Gu y Yuliang Zhao. (2020). Progress, challenges, and future of nanomedicine. Nano Today, 35 (diciembre): 101008. https://doi.org/10.1016/j.nantod.2020.101008
- Zhu, Junwen y Weishu Liu. (2020). A tale of two databases: the use of Web of Science and Scopus in academic papers. Scientometrics, 123 (1): 321-35. https://doi.org/10.1007/s11192-020-03387-8
1 N del E: La nanotecnología trata la comprensión, el control y manipulación de la materia en nanoescala, esto es, en dimensiones aproximadamente entre 1 y 100 nanómetros, donde fenómenos únicos posibilitan aplicaciones innovadoras y novedosas.
2 El diseño, caracterización, producción y aplicación de estructuras, aparatos y sistemas controlados y manipulados en forma y tamaño a escala nanométrica (a escala atómica, molecular o macromolecular) que produzca estructuras, aparatos y sistemas con al menos una novedosa, innovadora o superior característica o propiedad.